Composti del carbonio
Classificazione dei principali composti del carbonio
L'atomo di carbonio forma molti più composti degli altri elementi e quasi tutti i suoi composti sono classificati come organici con pochissime eccezioni.
I composti inorganici del carbonio corrispondono infatti a un piccolo numero: carbonati, cianuri, cianati e gli ossidi CO2 e CO.
Motivo di una così massiccia presenza di composti del carbonio, è la natura stessa dell'elemento ben sintetizzata dalla sua collocazione nella Tavola Periodica degli Elementi:
- posizione numero 6: numero atomico = numero di elettroni = 6
- gruppo IV: 4 elettroni nel livello energetico più esterno dell'atomo
- periodo 2: secondo livello energetico da completare
- non metallo tangente alla linea di separazione, ossia tendenza a costituire legami covalenti
Quanto sopra detto significa che il carbonio tende a formare tanti legami covalenti quanti sono gli elettroni del suo livello più esterno al fine di raggiungere l'ottetto ossia la configurazione più stabile in quanto simile a quella del gas nobile (così detto perché non reattivo) più vicino, il Neon. In tal modo, non solo le unità molecolari cui il carbonio dà origine sono geometricamente molto regolari (tetraedro) e caratterizzate dal massimo numero possibile di legami covalenti, ma ciò viene raggiunto nel minor spazio possibile (configurazione poco ingombrante) dato il basso numero di elettroni (posizione alta nella Tavola Periodica).
Per comprendere appieno la peculiarità del carbonio, lo si confronti con il silicio (simbolo chimico Si), uno degli altri elementi più presenti in natura sebbene più legato al mondo minerale: esso appartiene allo stesso gruppo del C e dunque ha una configurazione elettronica analoga e altrettanto ottimale (numero di elettroni di valenza = numero orbitali di valenza); d'altra parte, per l'appartenenza al periodo successivo e dunque per la presenza di 10 elettroni sul livello energetico 2, l'atomo di Si risulta molto più ingombrante e dunque incapace di instaurare legami molto forti data la lontananza obbligata dal nucleo.
Allo stesso modo, nel boro (B) i soli 3 elettroni del livello energetico più esterno disponibili per formare legami covalenti non sono sufficienti a raggiungere l'ottetto (si può arrivare al massimo a 6) e così le catene di atomi che si formano saranno instabili e reattive per carenza di ottetto; contemporaneamente la stessa geometria delle molecole così formate risulterà poco compatibile con la formazione di legami multipli.
Infine, l'azoto (N) presenta 5 elettroni sul livello energetico esterno con un eccesso di due elettroni rispetto al numero di legami covalenti necessari al raggiungimento dell'ottetto che, sebbene non impegnati in legami, interagiscono elettrostaticamente e repulsivamente con gli atomi legati.
In definitiva, le versatili proprietà chimiche del Carbonio gli permettono di dar luogo a catene di atomi (lineari, ramificate, aperte e chiuse) tramite legami covalenti (semplici e multipli) con se stesso o con etero-atomi, soprattutto idrogeno (H), azoto (N), ossigeno (O), fosforo (P) e zolfo (S). Quale espediente mnemonico si consiglia di ricordare la sigla CHNOPS!
Classificazione dei più importanti composti organici del carbonio
Criteri di discriminazione sono:
- tipo di etero-atomi (e gruppi funzionali) legati al C
- tipo di catena (lineare o ciclica)
- tipo di legami fra gli atomi di C (semplici o multipli)
In particolare, gli atomi o gruppi di atomi legati al carbonio giocano un ruolo fondamentale in quanto possono modificare la naturale tendenza del carbonio a formare, grazie alla regolarità geometrica del tetraedro e alla media elettronegatività del suo atomo, molecole apolari e dunque idrofobe (l'acqua è costituita da molecole polari e quindi tende a sciogliere molecole altrettanto polari). Si veda al proposito tabella seguente.
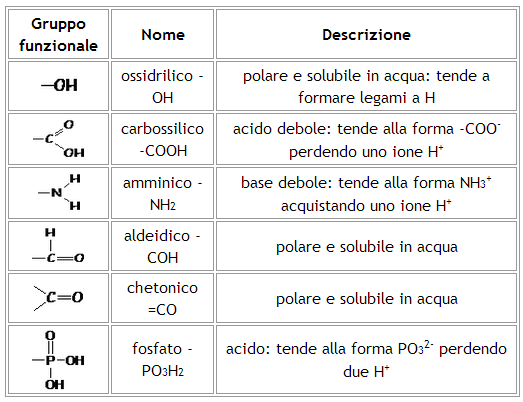
Idrocarburi
Formati solo da atomi di carbonio e idrogeno.
Saturi o paraffine (solo legami semplici tra C e per questo poco reattivi)
- Alcani (catene aperte CnH2n+2, -ano): metano, etano, propano, butano, pentano, esano, ... icosano (20C), etc.
![]()
metano
- Cicloalcani o nafteni (catene chiuse CnH2n, ciclo- -ano)
Insaturi (legami multipli tra C)
- Alcheni (catene aperte con un solo legame doppio CnH2n, -ene)
- Poliacheni (catene aperte con più di un legame doppio, -diene e –triene)
- Cicloalcheni (catene chiuse con uno o più legami doppi, ciclo- -ene e –diene e -triene)
- Aromatici (generalmente composti da catene chiuse di sei atomi C con tre doppi legami, da cui i radicali arilici). Agli aromatici appartiene il benzene.

benzene
-Alchini (catene aperte con un triplo legame CnH2n-2, -ino)
![]()
etino o acetilene
Alcoli (R-OH)

etanolo o alcol etilico CH3CH2OH

glicerolo o glicerina = propantriolo
Clicca per approfondimenti sugli alcoli
Eteri (R-O-R)
![]()
etere difenilico
Clicca per approfondimenti sugli eteri
Fenoli (-OH su idrocarburo aromatico)
Sono più acidi degli alcoli
![]()
fenolo (o acido fenico)
Clicca per approfondimenti sui fenoli
Acidi carbossilici (-COOH)
acido acetico
Clicca per approfondimenti sugli acidi carbossilici
Anidridi
Così chiamate perché si possono ottenere dalla disidratazione di acidi
![]()
anidride acetica
Clicca per approfondimenti sulle anidridi
Chetoni (RCOR)
chetone
acetone o propan-one
Clicca per approfondimenti sui chetoni
Aldeide (RCOH)
aldeide
aldeide formica o formaldeide o metan-ale
Clicca per approfondimenti sulle aldeidi
Esteri (-COO-)
Si ottengono dalla condensazione fra un alcool e un acido. I grassi sono esteri della glicerina con acidi carbossilici ad elevato numero di atomi C (acidi grassi). Inoltre alcune importanti materie plastiche (i poliesteri) sono esteri di acidi bicarbossilici (o anidridi) e alcoli con almeno due gruppi -OH
Clicca per approfondimenti sugli esteri
Ammine (-NH2)
Il gruppo amminico e il gruppo carbossilico possono essere contemporaneamente presenti in composti detti amminoacidi che per polimerizzazione (policondensazione) tra loro danno luogo a peptidi e proteine.

ammino acido generico
Clicca per approfondimenti sulle ammine.
Studia con noi