Alcani
Generalità e proprietà degli alcani
Gli alcani sono idrocarburi che impiegano solo legami singoli (legami di tipo sigma σ).
La formula generale degli alcani è CnH2n+2, dove n = 1, 2, 3, 4, ecc. Pertanto:
per n = 1 CH4 (metano)
per n = 2 C2H6 (etano)
per n = 3 C3H8 (propano)
per n = 4 C4H10 (butano)
per n = 5 C5H12 (pentano)
ecc.
Ovvero:
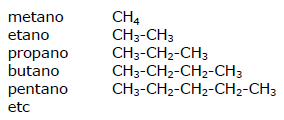
Per approfondimenti si veda la nomenclatura degli alcani.
Gli alcani sono anche chiamati idrocarburi saturi perché, per un dato numero di atomi di carbonio, contengono il più alto numero possibile di atomi di idrogeno.
Il carbonio negli alcani ha sempre una ibridazione sp3 e sono presenti solo singoli legami , perciò la configurazione di questa classe di composti è quella tetraedrica.
Nel metano, ad esempio, ci sono 4 legami sigma ( σ ), nati dalla sovrapposizione dei 4 orbitali ibridi sp3 del carbonio con 4 orbitali di tipo s dell'idrogeno.
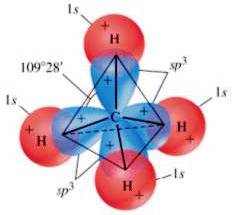
Struttura del metano
Isomeria degli alcani
Gli alcani, come molti altri composti organici, possono dare isomeri di struttura detti anche isomeri strutturali o isomeri di catena.
Per i primi tre termini degli alcani non ci sono problemi di questo tipo, ma con il butano si sono isolati due composti che corrispondono alla stessa formula bruta (C4H10) ma che presentano proprietà fisiche diverse.
Questi sono il n-butano e l'isobutano:
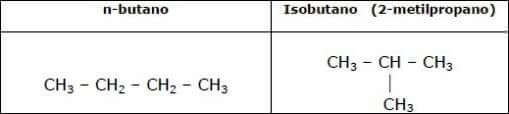
Isomeri di struttura del butano: si definisce "normale" la struttura lineare, mentre si definisce "iso" la struttura in cui un metile è legato al secondo atomo di C della catena lineare.
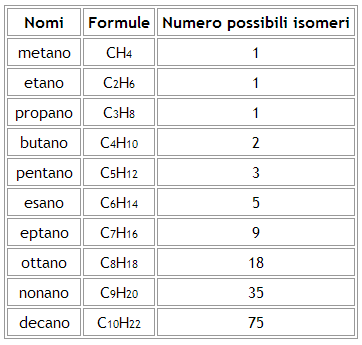
Come indicato nella tabella seguente, all'aumentare del numero di atomi di carbonio, aumenta anche il numero dei possibili isomeri:
Proprietà fisiche
Gli alcani a catena lineare dal metano al butano sono gassosi ed inodori, dal pentano al pentadecano (C15) sono liquidi ed i restanti sono solidi ed inodori.
Le caratteristiche fisiche (punto di ebollizione, punto di fusione, densità e viscosità) di questa classe omologa, variano con il peso molecolare. Gli isomeri lineari bollono a temperatura più alta di quelli ramificati. Così, ad esempio il n-butano, visto in precedenza, bolle a temperatura più alta dell'isobutano.
Gli alcani sono sostanze non polari e quindi insolubili in acqua ma sono buoni solventi per numerose sostanze organiche non polari. Hanno un lieve ma caretteristico odore di benzina. Hanno densità massima pari a 0,8 g/mL per cui galleggiano sul'acqua.
Tra molecole non polari (come quelle degli alcani) si esercitano deboli forze attrattive note come forze di London. L'intesità di queste forze cresce al crescere delle dimensioni molecolari: è per questo motivo che lo stato fisico degli alcani passa gradualmente - al crecere del numero di atomi di C - da gassoso a liquido a infine solido.
Esercizi sugli alcani
Li trovi al seguente link: esercizi sugli alcani.
Ti potrebbe interessare
Se sei invece interessato ad un software che permette di disegnare le molecole, allora vai alla seguente pagina: come si usa ChemSketch.
Link correlati:
Quiz online di chimica organica
Formula di struttura del 3-metilesano
Studia con noi