Forze di London
Generalità e proprietà delle forze di London
Le forze di London (dette anche interazioni dipolo istantaneo-dipolo indotto) sono forze attrattive tra molecole non polari.
Anche molecole di per sé non polari possono divenire, per brevissimi intervalli di tempo, molecole polari.
Ciò è dovuto al moto degli elettroni attorno al nucleo.
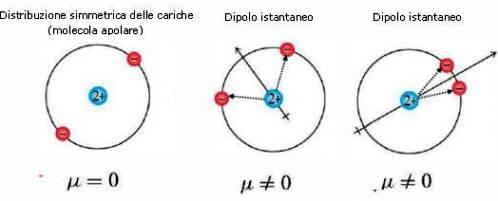
In un atomo, solitamente la distribuzione della nuvola elettronica è simmetrica rispetto al nucleo dell'atomo; i baricentri delle cariche negative e positive coincidono e la molecola è non polare.
In un dato istante può succedere però che la distribuzione della nuvola elettronica sia asimmetrica rispetto al nucleo e addensata da un lato.
Ciò determina la formazione di un dipolo istantaneo:
Ciascun dipolo istantaneo genera un campo elettrico che a sua volta induce un dipolo indotto nelle molecole circostanti:
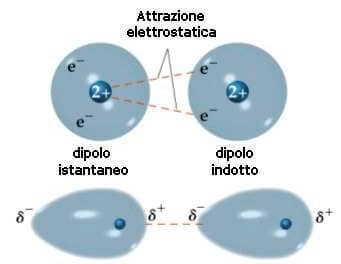
Tra il dipolo istantaneo e il dipolo indotto si viene a formare una forza attrattiva detta forza di London.
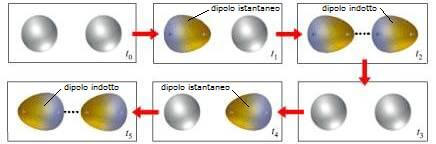
Sequenza delle interazioni tra un dipolo indotto e un dipolo istantaneo
È proprio grazie a questo tipo di interazione se molecole perfettamente apolari come O2 e N2 possono esistere allo stato condensato.
L'intensità delle forze di London aumenta all'aumentare delle dimensioni e della massa molecolare delle molecole.
È per questo motivo che F2 e Cl2 sono gassosi, Br2 è liquido mentre I2 è solido.
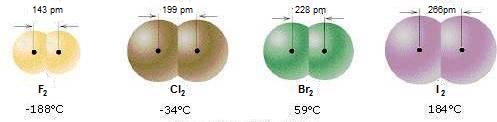
Temperature di ebollizione degli alogeni
Studia con noi