Legame covalente
Come avviene la formazione del legame covalente
Il legame covalente è un legame chimico che si forma tra atomi che hanno un alto valore di elettronegatività (e quindi una bassa differenza di elettronegatività): il legame covalente si forma quindi tra atomi "non metallici".
Esistono due tipi di legame covalente: il legame covalente puro e il legame covalente polare.
Il legame covalente puro (o covalente omeopolare) si realizza tra atomi dello stesso elemento.
Il legame covalente polare (o covalente eteropolare) si realizza tra atomi di elementi diversi (ma i due atomi devono avere una differenza di elettronegatività inferiore a 1,9).
Legame covalente puro
La natura del legame covalente venne proposta per la prima volta nel 1916 dal chimico americano Gilbert Lewis.
Lewis attribuì l'inerzia chimica dei gas nobili al fatto di possedere 8 elettroni di valenza e che gli elementi tendessero a raggiungere tale configurazione mediante una condivisione degli elettroni esterni (regola dell'ottetto).
Legame covalente singolo
Consideriamo come esempio la molecola del cloro (Cl2). I due atomi di cloro hanno una configurazione elettronica esterna 3s2 3p5 e presentano un elettrone esterno solitario (spaiato).
A ciascuno dei due atomi di cloro serve, pertanto, un solo elettrone per raggiungere la configurazione elettronica del gas nobile successivo (Argon).
Entrambi gli atomi attirano fortemente l'elettrone spaiato dell'altro ma avendo la stessa elettronegatività nessuno dei due riesce a strappare l'elettrone all'altro atomo.
Alla fine i due elettroni spaiati vengono condivisi da entrambi gli atomi: tale “condivisione” costituisce il legame covalente.
Ora i due elettroni non appartengono più all'uno o all'altro atomo, ma appartengono ad entrambi. Si dice che i due elettroni sono stati messi in comune o in compartecipazione.
Ciascun atomo di cloro ha ora attorno a sé 3 coppie di elettroni non condivise (coppie solitarie) e due elettroni condivisi che costituiscono un "doppietto di legame" per un totale di 8 elettroni.
La condivisione di una coppia di elettroni ha permesso a ciascun atomo di cloro di raggiungere l'ottetto.
Il legame che si forma attraverso la condivisione di una coppia di elettroni viene chiamato "legame covalente singolo" o più semplicemente "singolo legame" e viene rappresentato mediante un trattino che unisce i simboli chimici dei due atomi.

Si consideri ora la formazione del legame covalente nella molecola di idrogeno H2. I due atomi di idrogeno condividono il loro unico elettrone per raggiungere la configurazione elettronica del gas nobile successivo (Elio).

Quando i due atomi entrano in collisione, si legano insieme per formare la molecola H2. I due atomi di idrogeno, mettono in condivisione una coppia di elettroni, provenienti uno da un atomo e uno dall'altro atomo.

Legame covalente doppio
Talvolta, per raggiungere l'ottetto, due atomi devono condividere due coppie di elettroni. In tal caso nella molecola si viene a formare un doppio legame che viene rappresentato da due trattini.
Prendiamo come esempio la molecola dell'ossigeno O2. Secondo la teoria di Lewis, due atomi di ossigeno, ciascuno con sei elettroni nel livello esterno, quando formano la molecola dell'ossigeno O2, mettono in comune due elettroni ciascuno, per cui ogni atomo arriva alla configurazione ad ottetto.
Nella molecola è presente un doppio legame che viene rappresentato mediante due trattini posti tra i simboli chimici dei due atomi (O = O). Un legame doppio è più forte e più corto di un legame covalente singolo.

Legame covalente triplo
Due atomi di azoto, ciascuno con cinque elettroni nel livello esterno, quando formano la molecola N2, mettono in comune tre elettroni ciascuno, pertanto ogni atomo raggiunge la configurazione ad ottetto.
Il legame che si forma è un triplo legame che viene rappresentato con tre trattini posti tra i simboli chimici dei due atomi.
Un legame triplo è più forte e più corto di un legame doppio.

In generale, nei legami covalenti semplici è permessa la libera rotazione degli atomi intorno all'asse di legame, nei legami covalenti doppi e tripli tale rotazione non è permessa.
Legame covalente polare
Quando il legame covalente si forma tra atomi che presentano un diverso valore di elettronegatività, la nube elettronica degli elettroni che costituiscono il legame covalente è concentrata sull'atomo più elettronegativo. Si parla in questo caso di legame covalente polare.
Abbiamo visto che nel legame covalente puro, gli elettroni vengono condivisi tra atomi dello stesso elemento.
Ciascun atomo li attrae con la medesima elettronegatività e pertanto non c'è ragione di pensare che si possa avere un addensamento di carica elettrica negativa prevalentemente su uno o sull'altro dei due nuclei.
In altri casi però gli atomi che formano il legame covalente appartengono ad elementi diversi che presentano una diversa elettronegatività.
Consideriamo ad esempio la molecola dell'acido Cloridrico (HCl) nella quale H e Cl condividono una coppia di elettroni.

La coppia di elettroni che costituisce il legame covalente risulta spostata verso l'atomo più elettronegativo (in questo caso il Cl).
Quest'ultimo acquista quindi una carica parzialmente negativa (δ−, delta meno), mentre l'altro atomo (nel nostro caso H) assume una carica parzialmente positiva (δ+, delta più).
Si viene a creare pertanto un dìpolo (due poli) ed il legame corrispondente viene chiamato legame covalente polare.
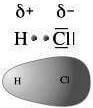
Nella figura seguente viene rappresentata la mappa della "densità elettronica" nella molecola dell'HCl.
La tonalità del rosso indica un addensamento di carica elettrica negativa, quelle in blu di carica elettrica positiva, mentre il verde indica la neutralità.

Quanto maggiore è la differenza di elettronegatività fra i due atomi che formano il legame, tanto più elevata è la polarità del legame.
Quando la differenza di elettronegatività fra i due elementi che intendono legarsi è superiore a 1.9, avviene un trasferimento di elettroni dall'atomo meno elettronegativo all'atomo più elettronegativo. Si realizza in questo caso un legame ionico.
Quiz sui legami chimici
Se ti interessano li trovi qui: quiz sui legami chimici.
Link correlati:
Qual è la differenza tra legame covalente e ionico?
Studia con noi