Massa atomica ed abbondanza isotopica
Determina la massa atomica del cloro sapendo che il cloro naturale è costituito da due isotopi
Determina la massa atomica del cloro sapendo che il cloro naturale è costituito da due isotopi.
Le abbondanze in natura e le masse atomiche degli isotopi sono rappresentate nella seguente tabella:
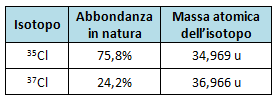
Svolgimento dell'esercizio
La maggior parte degli elementi che si trovano in natura sono costituiti da una miscela di isotopi che presenta una composizione costante.
In questi casi la massa di un elemento chimico viene determinata facendo la media ponderata delle masse atomiche di ciascun isotopo presente nella miscela naturale.
Essendo una media ponderata si tiene conto dell'abbondanza in natura di ciascun isotopo.
Quindi, per ogni elemento chimico il valore riportato nella tavola periodica non si riferisce alla massa atomica di un singolo isotopo, ma, come detto in precedenza, rappresenta la media ponderata delle masse atomiche di ciascun isotopo.
È possibile determinare la media ponderata delle masse dei due isotopi del cloro nel seguente modo:
![]()
Tale valore corrisponde alla massa atomica del cloro.
Link correlati:
esercizio sulla massa atomica del potassio
abbondanza percentuale dei due isotopi del bromo
massa di uno dei due isotopi del carbonio
Studia con noi