Acido cloroacetico
Proprietà e caratteristiche dell'acido cloroacetico
L'acido cloroacetico è un acido organico con formula bruta C2H3ClO2. Presenta la seguente struttura chimica:
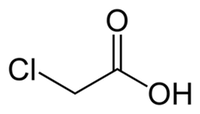
Si presenta in cristalli incolori - dall'odore pungente - facilmente solubili in acqua.
L'acido cloroacetico ha temperatura di fusione di 63°C, temperatura di ebollizione di 189 °C, densità di 1,58 g/cm3 e massa molare pari a 94,50 g/mol.

Acido cloroacetico.
Acidità dell'acido cloroacetico
L'acido cloroacetico, che è un derivato clorurato dell'acido acetico, è un acido più forte dell'acido acetico.
La maggiore acidità dell'acido cloroacetico (pKa = 2,8) rispetto a quella dell'acido acetico (pKa = 4,8) è dovuta alla presenza del cloro, un gruppo fortemente elettronattrattore.
Infatti, essendo legato al carbonio in α (alfa) al gruppo carbossilico ed essendo un elemento molto elettronegativo, il cloro ha un effetto elettronattrattore che stabilizza lo ione cloroacetato:

A causa dell'effetto elettronattrattore dell'atomo di cloro, si viene infatti a formare una piccola carica positiva (δ+) sul carbonio cui è legato il cloro che a sua volta induce una piccola carica positiva sull'atomo di carbonio adiacente, quello che lega i due atomi di ossigeno.
Questo effetto induttivo stabilizza lo ione carbossilato dell'acido cloroacetico riducendo la quantità di carica negativa che deve essere sopportata dal gruppo carbossilato.
L'acido cloroacetico (Cl-CH2-COOH) ha pertanto ha una maggiore tendenza a cedere il protone del gruppo carbossilico per trasformarsi nel più stabile ione cloroacetato (Cl-CH2-COO−).
Impieghi dell'acido cloroacetico
L'acido cloroacetico è molto importante per svariate sintesi organiche, soprattutto per la preparazione dell'indaco, dell'EDTA, della carbossimetilcellulosa, di pesticidi, coloranti e prodotti farmaceutici.
Link correlati:
forza degli acidi e delle basi
Studia con noi