Ibridazione sp
Ibridazione sp del carbonio
La configurazione elettronica dell'atomo di carbonio allo stato fondamentale è 1s2 2s2 2p2.
Essendovi solo 2 elettroni spaiati e tenendo conto che per la regola di Hund i 2 elettroni p devono occupare 2 degli orbitali degeneri p (degeneri = aventi la stessa energia), il carbonio dovrebbe essere in grado di formare unicamente due legami.
Per giustificare la formazione di 4 legami si deve ammettere che un elettrone dell'orbitale 2s venga "promosso" all'orbitale 2p vuoto: ciò avviene con assorbimento di una considerevole quantità di energia.

Nel caso della formazione di quattro legami covalenti, siccome l'orbitale atomico 2s sferico ha energia inferiore e forma diversa da quella dei tre orbitali 2p (2px, 2py, 2pz), dovremmo aspettarci la formazione di tre legami uguali ed uno diverso; l'equivalenza degli atomi di H nella molecola del metano (CH4) richiede invece che i 4 legami siano uguali e quindi che siano uguali i 4 orbitali impegnati in questi legami.
Secondo L. Pauling ciò può essere spiegato ammettendo una fusione e ridistribuzione di cariche chiamata ibridazione.
La teoria suggerisce il "mescolamento" dell'orbitale 2s con i tre orbitali 2p: tale mescolamento porta alla formazione di quattro orbitali ibridi sp3 (per info: ibridazione sp3).
Dal mescolamento dell'orbitale 2s con due orbitali 2p si ottiene invece l'ibridazione sp2.
Come avviene l'ibridazione sp?
Nell'atomo di carbonio allo stato eccitato, qualora avvenga l'ibridazione dell'orbitale s con un solo orbitale p, si ottengono invece due orbitali ibridi sp aventi per il 50% le caratteristiche dell'orbitale s di partenza e per il 50% le caratteristiche dell'orbitale 2p e la seguente forma:

Forma dell'orbitale sp: il lobo di dimensione maggiore è quello che viene utilizzato nei legami. Talvolta, per questioni di praticità, non si rappresenta il lobo di dimensione minore.
L'ibridazione dell'orbitale s con un solo orbitale p porta pertanto alla formazione di due orbitali ibridi sp:
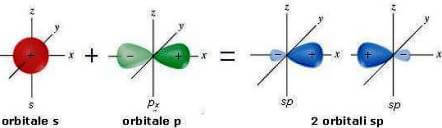
I due orbitali sp formano tra loro angoli di 180°:
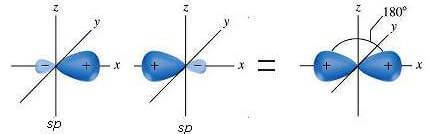
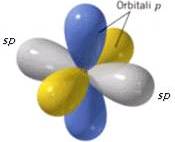
Invece, i due orbitali p rimasti inalterati sono perpendicolari ai due orbitali sp e formano tra loro angoli di 90°.
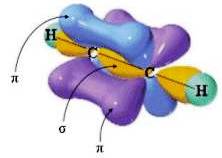
Se due atomi di carbonio con ibridazione sp si uniscono con un legame σ, e sono disposti in modo da avere i 2 orbitali p orientati nello stesso senso, tra questi atomi si stabiliscono 2 legami π. Si ha pertanto la formazione di un triplo legame come ad esempio nell'acetilene H-C≡C-H:
L'atomo di C con ibridazione sp può anche unirsi con 2 legami σ a 2 atomi di carbonio con ibridazione sp2 disposti in maniera da avere il restante orbitale p orientato nello stesso senso di quelli dell'atomo di C centrale. Gli orbitali p degli atomi di C laterali si dovranno pertanto trovare rispettivamente nel piano del foglio e su un piano ortogonale a questo. Tra gli orbitali ibridi si formeranno legami σ.
L'atomo centrale sarà legato ad altri due atomi di C con legami σ tra loro allineati e con 2 legami π giacenti l'uno nel piano del foglio e l'altro in un piano perpendicolare.
I quattro restanti legami σ dovranno trovarsi due sul piano perpendicolare al foglio e due sul piano del foglio. Ciò si ha nella molecola dell'allene.

Pertanto, nella molecola dell'allene i due doppi legami e quindi i due gruppi metilenici terminali si trovano su due piani differenti formanti l'un l'altro un angolo di 90°:

La geometria degli alleni ha come conseguenza che qualunque allene che abbia una sostituzione del tipo abC=C=Cba deve esistere in due forme enantiomere e deve mostrare attività ottica.
Link correlati:
Ibridazione dell'atomo di azoto
Studia con noi