Stereochimica
Che cos'è la stereochimica?
La stereochimica è una branca della chimica che studia le proprietà spaziali delle molecole e come queste influenzano le proprietà chimiche delle stesse; in altre parole, la stereochimica si occupa dello studio delle proprietà delle sostanze connesse con la diversa disposizione nello spazio degli atomi e delle molecole.
Quando tali proprietà sono limitate alle sostanze allo stato solido e dipendono dalla loro struttura cristallina, lo studio è pertinente alla cristallografia. La stereochimica può riguardare l'atomo di carbonio (in questo caso si parla di stereochimica organica) oppure anche altri elementi (in particolare l'azoto).
Il nome "stereochimica" fu proposto nel 1888 da V. Meyer per indicare quindi lo studio delle proprietà delle sostanze connesse con la diversa disposizione nello spazio degli atomi e delle molecole; quando tali proprietà sono limitate alle sostanze allo stato solido e dipendono dalla loro struttura cristallina, lo studio è pertinente alla cristallografia.
Le basi della stereochimica furono gettate nel 1848 da L. Pasteur con i suoi studi sull'attività ottica dell'acido tartarico e dei suoi sali.
Stereochimica del carbonio
Due composti si dicono isomeri se hanno la stessa formula bruta ma differiscono gli uni dagli altri per le loro proprietà fisiche e/o chimiche. Questi possono essere:
1) isomeri di struttura
Gli isomeri di struttura hanno la stessa formula bruta ma differiscono gli uni dagli altri poiché i loro atomi di carbonio sono uniti fra loro in un differente ordine. Esempi di isomeri di struttura sono il n-butano e l'isobutano:
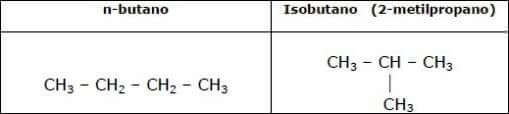
2) stereoisomeri
Gli stereoisomeri sono composti che pur avendo la stessa formula bruta e pur avendo gli atomi legati nello stesso identico ordine, differiscono in una diversa disposizione spaziale degli atomi. Gli stereoisomeri possono essere:
2.a) isomeri conformazionali: sono stereoisomeri che differiscono tra loro per una rotazione attorno al legame semplice C-C (gli atomi di carbonio sono generalmente liberi di ruotare attorno a un legame singolo e i loro sostituenti possono assumere varie disposizioni nello spazio o conformazioni); tali isomeri si interconvertono troppo rapidamente per permetterne una separazione e per questo motivo non sono fisicamente separabili.

Gli isomeri conformazionali differiscono per una rotazione attorno al legame semplice C-C.
2.b) isomeri configurazionali: sono stereoisomeri che possono essere trasformati gli uni negli altri solo attraverso uno scambio di posizione dei gruppi legati ad un medesimo atomo. Di seguito un esempio di isomeri configurazionali:

Per trasformare un stereoisomero nell'altro è necessario scambiare di posizione due sostituenti qualunque (nell'esempio vengono scambiati bromo e fluoro).
Gli isomeri configurazionali, a loro volta, possono essere di due tipi:
- enantiomeri: sono immagini speculari non sovrapponibili; molecole con tale caratteristica si dicono chirali. Esempi di enantiomeri sono le seguenti due molecole:

Le due molecole rappresentate sono enantiomeri, ovvero immagini speculari non sovrapponibili.
Gli enantiomeri hanno le stesse proprietà fisiche e chimiche (salvo che verso i reattivi otticamente attivi) tranne che il segno (ma non il valore assoluto) del potere rotatorio.
- diastereoisomeri: gli stereoisomeri che non sono enantiomeri sono chiamati diastereoisomeri. I diastereoisomeri hanno proprietà chimiche e fisiche differenti.

Le due molecole rappresentate sono due diastereoisomeri.
2.c) isomeri geometrici, o isomeri cis-trans: negli alcheni è dovuta al fatto che, intorno al doppio legame C=C, la libera rotazione è impedita. Esempi di isomeri cis-trans sono le seguenti due molecole:

Negli isomeri cis-trans, se i due sostituenti sono disposti dalla stessa parte rispetto al doppio legame si ha l'isomero cis, se i due sostituenti sono disposti dalla parte opposta rispetto al doppio legame, si ha l'isomero trans.
Gli isomeri geometrici hanno proprietà chimiche simili ma non uguali; anche le proprietà fisiche sono differenti: salvo rare eccezioni gli isomeri trans fondono a temperatura più alta, bollono a temperatura più bassa, hanno momento dipolare minore o nullo e minor calore di combustione.
Fornendo a un isomero la quantità di energia sufficiente a disaccoppiare gli orbitali che formano il legame π, la molecola diventa libera di ruotare attorno al legame σ e si riassesta nella forma più stabile nelle condizioni sperimentali. Un modo conveniente per fornire l'energia necessaria (alcune decine di kcal/mol) consiste nell'illuminare l'isomero con luce di bassa lunghezza d'onda; la forma più stabile alle ordinarie temperature è la trans.
Come rappresentato nella immagine seguente, l'isomeria cis-trans si può anche avere nei cicloalcani. Prendendo in considerazione l'1-4-dimetilcicloesano:

Nell'1-4-dimetilcicloesano i due gruppi metilici possono trovarsi entrambi dalla stessa parte del piano dell'anello (isomero cis) oppure da parti opposte (isomero trans).
Stereochimica dell'azoto
La configurazione dell'azoto è 1s2 2s2 2p3. Nei composti in cui l'N è legato con legami covalenti semplici (a H, a C, ecc.) si ha ibridazione tetraedrica sp3 degli orbitali.
Se l'N é sostituito con gruppi tra di loro differenti (ammine secondarie o terziarie) è prevedibile l'esistenza di due forme enantiomere. Non è però possibile isolare le due forme perché la barriera di energia che occorre superare per passare dall'una all'altra è così bassa che già a temperatura ambiente avviene con grande rapidità l'interconversione.

I composti in cui l'N è legato con un duplice legame ad altri atomi possono dare due isomeri. Questa isomeria, in tutto paragonabile all'isomeria geometrica dei composti etilenici, deriva dalla difficoltà di rotazione dell'N attorno al doppio legame. Le aldossime hanno due forme sin e anti:

Le aldossime hanno due forme sin e anti: il prefisso si riferisce alla posizione reciproca dell'H e dell'OH.
I due isomeri hanno differenti proprietà fisiche e chimiche.
Esercizi di stereochimica
Li trovi al seguente link: esercizi di stereochimica.
Studia con noi