pH di acidi e basi molto diluiti e/o molto deboli
Come si calcola il pH di acidi e basi molto diluiti e/o molto deboli
Quando si vuole determinare il pH di un acido debole molto diluito e/o molto debole, non è più possibile trascurare la concentrazione degli ioni H+ provenienti dalla dissociazione dell'acqua.
In questi casi vanno considerati entrambi gli equilibri:

Inoltre, la concentrazione degli ioni H+ provenienti dall'acqua non è 10-7M in quanto l'acqua, in risposta all'aumentata concentrazione degli ioni H+ da parte dell'acido debole, sposta il suo equilibrio verso sinistra (principio di Le chatelier) contribuendo ad un apporto di ioni H+ minore di 10-7 mol/l.
In modo analogo, la concentrazione degli ioni H+ provenienti dall'acido è inferiore rispetto a quanto si avrebbe senza tener conto della dissociazione dell'acqua.
Calcolo del pH di acidi debolissimi
Senza addentrarci nei complicati calcoli che portano alla formula finale, nel caso di acidi debolissimi per i quali valgono le seguenti condizioni:
Ka ≤ 10-7 e C· Ka < 10-12;
la concentrazione degli ioni H+ può essere determinata attraverso la seguente formula:
![]()
Calcolo del pH di acidi deboli molto diluiti
Nel caso di acidi deboli molto diluiti per i quali valgono le seguenti condizioni:
Ka > 10-7 e C ≤ 10-7
la concentrazione degli ioni H+ può essere determinata attraverso la seguente formula:
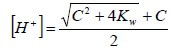
Acidi deboli che non ricadono nei casi precedenti
Nel caso di acidi deboli per i quali valgono le seguenti condizioni:
Ka > 10-7 ; C > 10-7 ; C/Ka < 102
la concentrazione degli ioni H+ può essere determinata attraverso la seguente formula:

Riassumendo
Nello schema seguente vengono riportate le quattro formule utili per il calcolo della concentrazione degli ioni H+ in funzione di Ka e di C:

Esplicitando i valori di Ka e C possiamo disegnare il seguente grafico:

Esercizi sul pH
Li trovi al seguente link: esercizi sul pH.
Studia con noi