Equazione di Clapeyron
Spiegazione della equazione di Clapeyron
L'equazione di Clapeyron esprime l'influenza di una variazione di temperatura sul valore della pressione di vapore, nell'equilibrio liquido-vapore.
Lo studio termodinamico di questo fenomeno porta ad un risultato (appunto l'equazione di Clapeyron) di validità generale per ogni tipo di equilibrio fra due fasi della stessa specie chimica.
Si consideri un recipiente chiuso contenente un liquido puro in equilibrio col suo vapore, alla temperatura T e alla pressione P: poiché un sistema termodinamico costituito da una sola specie chimica è definito in ogni suo stato soltanto dalle due variabili intensive pressione e temperatura (non esiste la variabile concentrazione), per l'equilibrio liquido/vapore considerato, per il quale è Pv = Pl, Tv = Tl è anche Gv = Gl.
Ciò significa che l'energia libera di 1 mole di vapore è uguale all'energia libera di una mole di liquido.
Se si opera una variazione infinitesima della temperatura, portando questa al valore T ± dT, il sistema raggiunge un nuovo stato di equilibrio, infinitamente vicino al precedente, cui corrisponde un valore della pressione P ± dP, per il quale è Gl ± dGl = Gv ± dGv, e quindi anche dGv = dGl.
Ricordando che G = H - T · S e che per definizione di entalpia è H = U + P · V, è anche G = U + P · V - T · S.
Per una variazione infinitesima di G si ha:
dG = dU + P · dV + V · dP - T · dS - S · dT
Applicando ora il primo principio della termodinamica al nostro processo reversibile per il quale l'unico lavoro possibile è del tipo P/V, si ha:
dU = dQrev - dLrev
poiché è dQrev = T · dS e dLrev = P · dV è anche:
dU - T · dS + P · dV = O.
Di conseguenza la seguente relazione:
dG = dU + P · dV + V · dP - T · dS - S · dT
diventa:
dG = V · dP — S · dT
e la seguente relazione vista in precedenza:
dGv = dGl
può scriversi, indicando con Vv e Vl i volumi molari del liquido e del vapore:
Vv · dP - Sv · dT = Vl · dP - Sl · dT
Cioè per il passaggio liquido → vapore può scriversi (raccogliendo i termini in dP e in dT):
dP / dT = (Sv - Sl) / (Vv - Vl)
La differenza di entropia Sv - Sl può misurarsi facendo evaporare reversibilmente alla temperatura T una mole di liquido, e misurando la quantità di calore a ciò necessaria: questa, per definizione di entalpia, è una entalpia di evaporazione (ΔHev) e quindi:
Sv - Sl = ΔHev / T
La seguente relazione:
dP / dT = (Sv - Sl) / (Vv - Vl)
può allora può scriversi:
dP / dT = ΔHev / [T · (Vv - Vl)]
Ponendo in luogo della entalpia di evaporazione l'entalpia (ΔH) del generico passaggio di stato (ad esempio di fusione, di sublimazione, ecc.) e in luogo di Vv - Vl la differenza (ΔV) fra i volumi molari dei due stati di aggregazione fra cui avviene il passaggio di stato (ad esempio Vl - Vs in una fusione ), la relazione precedente può essere generalizzata nel seguente modo:
![]()
Questa equazione, nota come equazione di Clapeyron (1834), è valida per ogni passaggio di stato o di fase di un sistema costituito da una unica specie chimica, nel quale cioè tutte le fasi hanno uguale composizione.
Equazione di Calpeyron applicata agli equilibri eterogenei in cui esiste una fase gassosa
Alcune lecite approssimazioni e limitazioni consentono di scrivere l'equazione di Clapeyron in modo più conveniente per essere applicata agli equilibri eterogenei in cui esista una fase gassosa (cioè agli equilibri liquido/vapore e solido/vapore ):
- si ammette che il volume occupato da una mole di una specie chimica allo stato liquido (Vl) (o solido) sia trascurabile rispetto a quello occupato dalla stessa mole allo stato di vapore (Vv): cioè Vv - Vl = Vv;
- si ammette che il vapore abbia comportamento ideale e si applica ad esso l'equazione di stato del gas ideale; per una mole è Vv = R · T / P;
- si ammette che ΔHev (o ΔHsublimazione) si mantenga praticamente costante nel campo di temperatura che si considera.
In base alle approssimazioni precedenti, l'equazione di Clapeyron vista in precedenza può scriversi (riferendosi alla evaporazione) nel seguente modo:
dP / dT = P · ΔHev / (R · T2)
che integrata e passando ai logaritmi decimali, diventa:
![]()
L'equazione precedente applicata al passaggio di stato liquido → vapore mostra che la pressione di vapore aumenta logaritmicamente con la temperatura assoluta; ciò fino alla temperatura critica, oltre la quale non sussiste il sistema bifasico liquido/vapore; la pressione critica rappresenta perciò il valore limite della pressione di vapor saturo di un liquido.
Riportando i valori di log P contro i valori 1/T di un dato liquido (ottenuti sperimentalmente da misure di pressione di vapore a temperature diverse) si ottiene una retta, dalla cui pendenza, espressa dal termine -ΔHev / (2,303 ·R) si ricava il valore ΔHev del predetto liquido.
Nella seguente immagine è rappresentata la dipendenza della pressione di vapore dalla temperatura per alcuni liquidi: etere etilico (I); acetone (II); etanolo (III); acqua (IV).
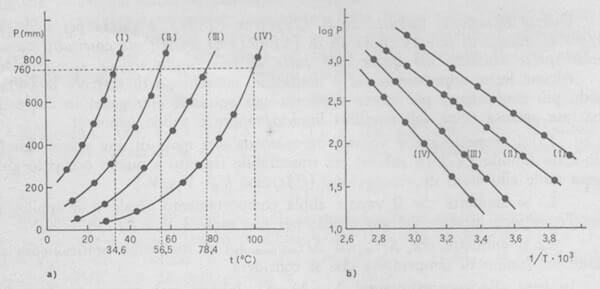
(a) Variazione della pressione di vapore P in torr (mmHg) con la temperatura t (°C).
(b) Variazione di log P con l'inverso della temperatura assoluta (1/T). Nella scala del diagramma i valori di 1/T sono moltiplicati per un fattore 103.
Dalla relazione:
![]()
con una opportuna operazione di integrazione si ottiene la seguente relazione:
![]()
nella quale P1, P2 sono i valori delle pressioni di vapore di un dato liquido alle temperature T1 e T2.
L'equazione precedente può essere scritta anche nel seguente modo:
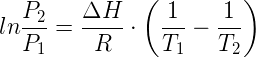
La relazione precedente ha grande importanza pratica perché consente, noto il valore della pressione di vapore (P1) ad una temperatura (T1), di calcolare il valore della pressione di vapore (P2) ad un'altra temperatura (T2); naturalmente il valore ΔH deve poter essere considerato praticamente costante, e perché ciò sia lecito le temperature T1 e T2 debbono differire di pochi gradi (meno di 15°C).
Esercizio
Sapendo che alla pressione di 1 atm l'acqua bolle alla temperatura di 100°C, si determini a quale temperatura bolle l'acqua alla pressione di 0,48 atm. Si consideri ΔHeb = 539 kcal/kg.
Lo svolgimento dell'esercizio lo trovi qui: esercizio sull'equazione di Clausius–Clapeyron.
Studia con noi