Sistema Termodinamico
Definizione di sistema termodinamico aperto, chiuso e isolato
In questa lezione spiegheremo che cos'è un sistema termodinamico e ne daremo la definizione.
Spiegheremo infine, riportando anche degli esempi, come possono essere classificati i sistemi termodinamici.
Definizione di sistema termodinamico
Per sistema termodinamico si intende quella parte dell'Universo oggetto di studio.
Un sistema termodinamico deve essere costituito almeno da una porzione percettibile di materia; usualmente è costituito da un insieme macroscopico, omogeneo od eterogeneo, di corpi.
Sono ad esempio sistemi termodinamici: una certa quantità di ossigeno, una quantità d'acqua, un pezzo di ferro, un sasso, una porzione di acqua, il pianeta Terra, una pianta, un moscerino, un bicchiere, ecc.
Definire un sistema termodinamico significa quindi considerare una porzione definita di materia (sistema) distinta dal resto dell'Universo (ambiente).
Quindi non scordare: un sistema termodinamico è una ben definita quantità di materia separata dall'esterno!
Classificazione dei sistemi termodinamici
I sistemi termodinamici (o semplicemente sistemi), possono essere classificati in: sistemi isolati, sistemi chiusi e sistemi aperti.
Definiamo brevemente questi tre tipi di sistemi riportando anche degli esempi.
Sistema isolato
Un sistema isolato è un sistema termodinamico che non può scambiare con l'esterno né materia né energia.
Un sistema isolato è un concetto puramente teorico in quanto qualsiasi sistema scambia, anche se con velocità molto basse, energia con l'ambiente; viene considerato sistema isolato solo l'Universo.
Sistema chiuso
Un sistema chiuso è un sistema termodinamico che può scambiare con l'esterno energia ma non materia. Una bottiglia tappata è un esempio di sistema chiuso: può cedere o assorbire calore dall'ambiente ma non può cedere o assorbire materia.

Le bottiglie tappate sono un esempio di sistema termodinamico chiuso.
Anche il pianeta Terra può essere considerato un sistema chiuso: escludendo l'apporto di materia fornito dalle meteoriti, la Terra scambia con lo spazio cosmico solo energia, che costantemente riceve dal Sole - per esempio - sotto forma di radiazione luminosa e che in parte restituisce sotto forma di calore.
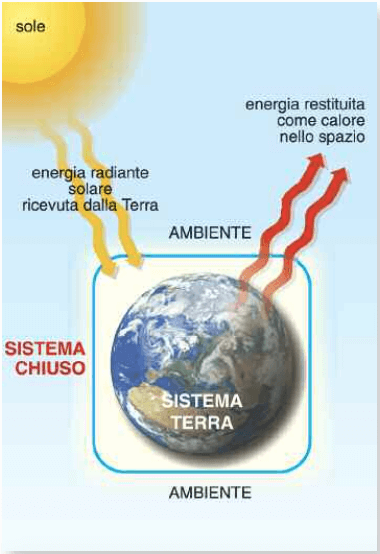
La Terra è un sistema termodinamico chiuso: scambia con lo spazio cosmico energia ma non materia.
Un altro esempio di sistema chiuso è infine il circuito di riscaldamento domestico.
Sistema aperto
Un sistema aperto è un sistema termodinamico che può scambiare con l'esterno sia energia che materia.
Il corpo umano è un esempio di sistema aperto: si nutre, respira consumando ossigeno e allo stesso tempo emette calore e si riscalda ai raggi del Sole.
Altri esempi di sistemi aperti sono: i liquidi in contenitori non ermeticamente chiusi, gli organismi viventi, il motore acceso di una macchina, ecc.
Anche una pianta è un sistema aperto: consuma l'anidride carbonica nel processo di fotosintesi clorofilliana durante il quale assorbe l'energia radiante del Sole liberando contemporaneamente ossigeno; non ultimo una pianta assorbe dal terreno i sali minerali.
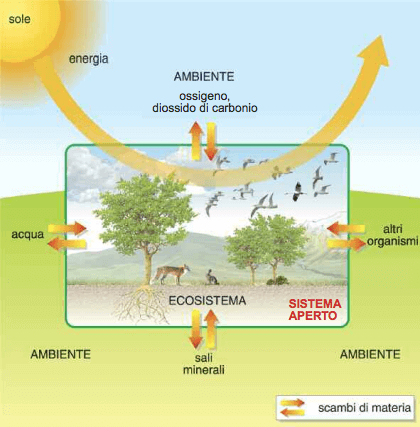
Le piante sono sistemi termodinamici aperti: effettuano con l'ambiente sia scambi di energia che scambi di materia.
Energia interna di un sistema termodinamico
L'energia interna di un sistema termodinamico viene solitamente indicata con la lettera U e nel Sistema Internazionale si misura in joule; è data dalla somma dell'energia cinetica Ec e dell'energia potenziale Ep delle particelle che lo compongono. In formule:
U = Ecinetica + Epotenziale
Proprietà di un sistema termodinamico
Elenchiamo di seguito due importanti proprietà dei sistemi termodinamici.
1) Un sistema termodinamico è all'equilibrio quando le grandezze fisiche che lo caratterizzano (temperatura, pressione, volume, ecc.) si mantengono di valore costante nel tempo.
2) Un sistema che non è all'equilibrio tende spontaneamente a evolvere per raggiungere tale condizione.
Descrivere termodinamicamente un sistema significa conoscere il numero minimo di parametri (come ad esempio la temperatura, la pressione, la composizione, etc.) che definiscono in modo univoco il sistema. Conoscere tali parametri, noti come variabili di stato, permette di potersi costruire una copia perfetta del sistema considerato.
Studia con noi