Primo Principio della Termodinamica
Enunciazione e spiegazione del primo principio della termodinamica
Il primo principio della termodinamica (enunciato da R. Clausius nel 1865) afferma che: l'energia può essere converita da una forma in un'altra ma non può essere né creata né distrutta.
Ogni sistema ha un suo contenuto di energia (energia interna, U) dovuta a tutti i contributi di energia legati al suo stato: energia dovuta al legame tra nucleo ed elettroni, energia nucleare, energia cinetica, ecc.
Il valore dell'energia U di un sistema non è noto; questo però non costituisce una limitazione in quanto la termodinamica si occupa soprattutto delle differenze di energia tra due stati diversi e non ai valori assoluti dell'energia in ciascuno stato.
Quindi, in base al primo principio della termodinamica, affinché si abbia variazione dell'energia interna di un sistema, questo deve scambiare energia con l'esterno. Ogni scambio di energia fra un sistema e l'esterno avviene o tramite lavoro o per passaggio di calore.
Quindi: un sistema può variare il proprio contenuto di energia solo attraverso scambi di calore e di lavoro con l'ambiente.
È questo un modo alternativo di enunciare il primo principio della termodinamica.
Pertanto:
∆U = Q - L
in cui:
- ∆U = variazione di energia interna subita dal sistema durante la trasformazione;
- Q = quantità di calore scambiata con l'ambiente;
- L = lavoro in gioco nella trasformazione*.
Secondo una convenzione detta "primo criterio" o "criterio misto" il calore Q è positivo se passa dall'ambiente al sistema, mentre il lavoro L è positivo se compiuto dal sistema.
Tale convenzione si contrappone a quella nota come "egoistica" secondo cui sia il lavoro che il calore sono considerati positivi quando vengono forniti al sistema. Utilizzando tale convenzione, l'espressione del primo principio della termodinamica diventa:
∆U = Q + L
Poiché l'energia non può essere né creata né distrutta ma solo trasferita dal sistema all'ambiente o viceversa, per il sistema isolato (sistema + ambiente) vale la relazione:
∆U (sistema isolato) = 0
per cui, ad una determinata variazione dell'energia del sistema corrisponde una identica - ma di segno opposto - variazione di energia dell'ambiente.
L'energia interna è una funzione di stato
Se un sistema non isolato passa da uno stato che chiamiamo a ad uno stato che chiamiamo b, la variazione di energia interna del sistema è:
∆U = Ub -Ua.
Il passaggio dallo stato a allo stato b può avvenire in infiniti modi.
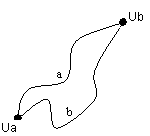
L'esperienza dimostra che il valore ∆U = Ub -Ua è indipendente dal cammino percorso: l'energia interna è pertanto una funzione di stato.
Bisogna fare però un'osservazione importante.
Nella relazione ∆U = Q - L è il valore di ∆U che non dipende dal cammino effettuato ma non i valori di Q e di L presi singolarmente.
Infatti sia i valori di Q che i valori di L dipendono dal cammino percorso, ed è solo la differenza Q - L (= ∆U) che resta costante.
* Nei sistemi termodinamici in cui sono coinvolti dei gas, rivestono grande importanza le trasformazioni fatte avvenire a pressione costante.
Per tali trasformazioni il lavoro meccanico viene determinato con la seguente relazione:
L = P · ∆V = P (V2 - V1)
Studia con noi