Sostituenti orto, meta e para orientanti
Effetti di orientazione dei sostituenti
La posizione dell'attacco di un gruppo elettrofilo a un anello benzenico in cui sia presente già un sostituente, dipende dal tipo di sostituente legato all'anello benzenico.
A tale riguardo i sostituenti possono essere classificati in due categorie: orto-para orientanti o meta orientanti.
Ad esempio, i gruppi nitro e carbossi sono definiti meta-orientanti, poiché dirigono l'elettrofilo entrante nella posizione meta.
I gruppi ammino, metile e cloro sono invece orto-para-orientanti, perché danno, in prevalenza, una miscela di reazione in cui prevalgono gli isomeri orto e para.
Sperimentalmente si può osservare che:
I gruppi disattivanti sono meta-direttori, ad eccezione degli alogeni che sono orto-para-orientanti
I gruppi attivanti sono tutti orto-para-orientani
Classificazione dei gruppi sostituenti comuni, secondo i loro effetti orto-para o meta-orientanti
Nella tabella seguente compaiono i sostituenti che di solito si incontrano nei composti aromatici, divisi in classi orto-para e meta-orientanti:

Esempi di sostituzioni orto-para e meta-orientanti
Un esempio di orientazione orto-para orientante è la nitrazione del clorobenzene. La tabella precedente ci informa che il cloro è un sostituente orto-para orientante, per cui la nitrazione del clorobenzene produce solo una miscela di isomeri orto e para:

Viceversa, essendo il gruppo nitro un sostituente meta-orientante, la clorurazione del nitrobenzene produce essenzialmente il prodotto meta:

Orientazione in presenza di più sostituenti
Quando sul benzene sono presenti due sostituenti, valgono le seguenti regole:
1) Se i due gruppi dirigono l'elettrofilo sul medesimo atomo di carbonio gli effetti dei due gruppi cooperano.
Ad esempio, nella sostituzione elettrofila aromatica del p-nitrotoluene, il gruppo metile tenderà ad introdurre l'elettrofilo in orto rispetto a se stesso (essendo bloccata la posizione para); il gruppo nitro tenderà a dirigerlo in meta rispetto a se stesso. In questo caso gli effetti dei due gruppi cooperano e dirigono l'elettrofilo sul medesimo atomo di carbonio. È quindi facile prevedere il prodotto finale:
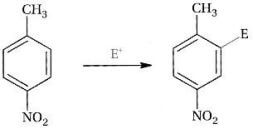
2) Se le orientazioni dei due gruppi sono contrastanti, prevale l'orientazione del gruppo più attivante. In altre parole, l'attivante più potente prevale sugli attivanti più deboli che, a loro volta prevalgono sui disattivanti.
Ad esempio, nella nitrazione del p-bromofenolo è predominante l'orientazione del gruppo idrossilico, che è più attivante del bromo:

3) Per ragioni steriche, un gruppo entrante tende a non andare in mezzo ad altri due gruppi in meta fra di loro:

Studia con noi