Reazioni di Ordine Zero
Equazione cinetica delle reazioni di ordine zero
La legge cinetica delle reazioni di ordine zero è data dalla seguente relazione matematica:
![]()
da cui risulta che la velocità di reazione è indipendente dalla concentrazione dei reagenti. In essa la costante cinetica k viene misurata in (mol · L-1 · s-1).
Integrando la relazione precedente è possibile ottenere l'equazione di velocità integrata che mette in relazione la concentrazione del reagente A in funzione del tempo di reazione t:
![]()
nella quale:
- [A]0 indica la concentrazione iniziale del reagente A
- [A]t indica la concentrazione del reagente A al tempo t
- t indica il tempo di reazione
- k indica la costante cinetica
Riportando in un sistema di assi cartesiani la [A] in funzione del tempo t, si ottiene una retta con pendenza -k.
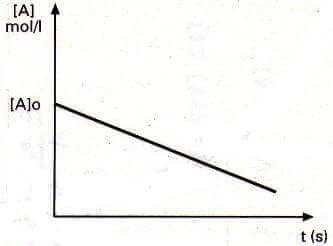
Reazione di ordine zero
Tempo di dimezzamento in una reazione di ordine zero
Il tempo di dimezzamento di una reazione di ordine zero dipende dal valore della concentrazione iniziale.
Poniamo infatti:
[A]t = ½ [A]o
Sostituendo questo dato nella:
![]()
si ha:
½ [A]o = [A]o - k · t½
Ovvero:
½ [A]o = k · t½
per cui:
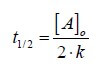
Esempi di reazione di ordine zero
Esempi di reazione di ordine zero sono le reazioni fotochimiche e le reazioni che avvengono nel campo della catalisi eterogenea.
Esercizi di cinetica chimica
Li trovi al seguente link: esercizi di cinetica chimica.
Link correlati:
chimica fisica Atkins (libro)
Studia con noi