Pila a concentrazione
Pila a concentrazione: principio di funzionamento
Le pile a concentrazione sono pile in grado di erogare corrente elettrica sfruttando due semicelle galvaniche contenenti la medesima specie chimica a due concentrazioni diverse.
In altre parole le pile a concentrazione sono pile formate da due elettrodi dello stesso metallo immersi in due soluzioni di un suo sale a diversa concentrazione.
Le due soluzioni sono separate da un ponte salino o da un setto poroso.
La pila viene schematizzata nel seguente modo:
(-) M | M+(C2) || M+(C1) | M (+)
in cui C1 > C2
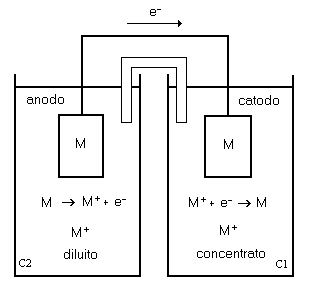
Schema di una pila a concentrazione
Le reazioni che si sviluppano agli elettrodi sono le seguenti:
al polo (-) : M → M+ (C2) + 1e−
al polo (+): M+ (C1) + 1e− → M
reazione globale: M+ (C1) → M+ (C2)
F.e.m. di una pila a concentrazione
La f.e.m. della pila, nel caso in cui vi è un solo elettrone scambiato, è:
![]()
da cui:
![]()
A temperatura costante la fem di una pila a concentrazione, dunque, dipende unicamente dal rapporto tra le concentrazioni delle specie contenute nelle due semicelle.
Considerando i processi che avvengono agli elettrodi:
al polo (-) : M → M+ (C2) + 1e−
al polo (+): M+ (C1) + 1e− → M
reazione globale: M+ (C1) → M+ (C2)
è facile intuire che il processo globale non consiste in una reazione chimica (anche se nelle due semicelle si verificano semireazioni redox), bensì in una diluizione della soluzione a concentrazione maggiore e un aumento della concentrazione della soluzione a concentrazione inferiore. La pila è scarica quando C1 = C2.
Nel caso in cui, gli elettroni scambiati fossero più di uno, la fem della pila può essere determinata con la seguente equazione:
![]()
in cui n corrisponde al numero di elettroni scambiati.
Esercizi sulle pile
Li trovi al seguente link: esercizi sulle pile.
Studia con noi