pH al punto di equivalenza
Calcolo del pH al punto di equivalenza
Il punto di equivalenza (o punto stechiometrico) è quel punto di una titolazione in cui la soluzione titolata (che può essere una base o un acido) ha reagito completamente con la soluzione titolante (che può essere rispettivamente un acido o una base).
1) pH al punto di equivalenza nella titolazione di un acido forte con una base forte (o viceversa)
È il caso della titolazione di HCl con NaOH. Al punto di equivalenza avviene quantitativamente la seguente reazione chimica:
NaOH + HCl → NaCl + H2O
Al punto di equivalenza le moli di base forte aggiunte sono esattamente uguali alle moli di acido. NaOH ha reagito completamente con HCl formando il cloruro di sodio, NaCl. Poiché il sale che si ottiene non subisce idrolisi, il pH della soluzione è 7 (pH neutro).
Pertanto, nella titolazione di un acido forte con una base forte (o di una base forte con un acido forte) il pH al punto di equivalenza è 7.
Non in tutti i tipi di titolazioni il pH al punto di equivalenza è necessariamente neutro (ovvero pH = 7), in quanto, in alcuni casi, il sale che si viene a formare può dare luogo ad una reazione di idrolisi.
2) pH al punto di equivalenza nella titolazione di una base debole con un acido forte
È questo il caso della titolazione di NH3 (ammoniaca) con HCl (acido cloridrico) secondo la reazione:
NH3 + HCl → NH4Cl
Al punto di equivalenza le moli di acido forte aggiunte sono esattamente uguali alle moli di base debole. HCl ha reagito completamente con NH3 formando il cloruro di ammonio, NH4+Cl−. Ma il sale che si ottiene subisce idrolisi acida secondo l'equazione:
NH4+ + H2O → NH3 + H3O+
Lo ione Cl− provenendo invece da un acido forte (HCl) non dà idrolisi e rimane in soluzione come "ione spettatore".
Pertanto, il pH al punto di equivalenza nella titolazione di una base debole con un acido forte è minore di 7 (pH acido). Per il calcolo della concentrazione idrogenionica vale la seguente relazione:
![]()
in cui la concentrazione Cs del sale si può determinare applicando la seguente formula:
![]()
in cui Cb è la concentrazione iniziale della base, Va e Vb sono i volumi di base e di acido che hanno reagito e Kb è la costante basica della base debole (nel nostro esempio NH3).
3) pH al punto di equivalenza nella titolazione di un acido debole con una base forte
È questo il caso della titolazione di CH3COOH (acido acetico) con NaOH (idrossido di sodio) secondo la reazione:
CH3COOH +NaOH → CH3COONa + H2O
Al punto di equivalenza le moli di base forte aggiunte sono esattamente uguali alle moli di acido debole. NaOH ha reagito completamente con CH3COOH formando l'acetato di sodio, CH3COO−Na+. Ma il sale che si ottiene subisce idrolisi basica secondo l'equazione:
CH3COO− + H2O →CH3COOH + OH−
Lo ione Na+ provenendo invece da una base forte (NaOH) non dà idrolisi e rimane in soluzione come "ione spettatore".
Pertanto, il pH al punto di equivalenza nella titolazione di un acido debole con una base forte è maggiore di 7 (pH basico). Per il calcolo della concentrazione degli ioni OH− vale la seguente relazione:
![]()
in cui la concentrazione Cs del sale è calcolabile con la seguente formula:
![]()
e Ka è la costante acida dell'acido debole (nel nostro esempio CH3COOH).
4) pH al punto di equivalenza nella titolazione di un acido debole con una base debole (o viceversa)
È questo il caso della titolazione di CH3COOH (acido acetico) con NH3 (ammoniaca) secondo la reazione:
CH3COOH +NH3 → CH3COONH4
Al punto di equivalenza le moli di base debole aggiunte sono esattamente uguali alle moli di acido debole. CH3COOH ha reagito completamente con NH3 formando l'acetato di ammonio, CH3COO−NH4+. Ma entrambi gli ioni che costituiscono il sale subiscono idrolisi secondo l'equazione:
CH3COO− + H2O →CH3COOH + OH−
NH4+ + H2O → NH3 + H3O+
Pertanto, il pH al punto di equivalenza nella titolazione di un acido debole con una base debole può essere maggiore, minore o uguale a 7 a seconda della forza degli acidi coniugati e delle basi coniugate. Per il calcolo della concentrazione degli ioni H+ vale la seguente relazione:
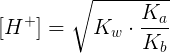
in cui Ka è la costante acida dell'acido debole (nel nostro esempio CH3COOH) mentre Kb è la costante basica della base debole (nel nostro esempio NH3). In questo tipo di titolazione:
a) se Ka = Kb allora pH = 7
b) se Ka > Kb allora pH < 7
c) se Ka < Kb allora pH > 7
Esercizi sulle titolazioni
Li trovi al seguente link: esercizi sulle titolazioni.
Studia con noi