Legge di Gay-Lussac
Enunciato e spiegazione della legge di Gay-Lussac
La legge di di Gay-Lussac o legge dell'isocora afferma che: a volume costante, la pressione di una data quantità di gas è direttamente proporzionale alla sua temperatura assoluta.
In termini matematici:
P1 : T1 = P 2 : T2
in cui:
P1 = pressione del gas alla temperatura T1
T1 = temperatura assoluta del gas
P2 = pressione del gas alla temperatura T2
T2 = temperatura assoluta del gas
In termini matematici la legge di Gay-Lussac potrebbe essere scritta anche nel seguente modo:
P = k · T
infatti a volume costante P e T sono direttamente proporzionali. L'equazione precedente può essere scritta anche come:
P/T = k
Scrivere P/T = k significa anche scrivere (per due stati generici che indichiamo con i pedici 1 e 2):
P1/T1 = P2/T2
che altro non è che la seguente proporzione vista precedentemente:
P1 : T1 = P2 : T2
Quesito
Possiamo affermare che la pressione di un gas, mantenuto a volume costante, raddoppia se la sua temperatura passa da 20°C a 40°C?
Svolgimento dell'esercizio
No, non raddoppia. Infatti per raddoppiare la pressione di un gas mantenuto a volume costante bisogna raddoppiare la sua temperatura assoluta e non quella in gradi centigradi. Passando da 20°C (= 293 K) a 40°C (=313 K) la temperatura assoluta passa da 293K a 313 K e quindi non raddoppia.
Spiegazione della legge di Gay-Lussac
In modo analogo alla legge di Charles, Gay-Lussac riuscì a dimostrare sperimentalmente che esiste una relazione matematica tra la pressione di un gas e la sua temperatura in gradi Celsius:
Pt = P 0 · (1 + α · t)
nella quale:
- α = coefficiente di espansione; è una costante che vale 1/273
- P0 = pressione del gas alla temperatura di 0°C
- Pt = pressione del gas ad una certa temperatura t in °C
In altri termini, mantenendo costante il volume del gas, a ogni incremento di temperatura di 1°C corrisponde un aumento della pressione pari a 1/273 della pressione esercitata alla temperatura di 0°C.
L'equazione precedente:
Pt = P0 · (1 + α · t)
può essere scritta anche come:
Pt = P0 + P0 ·α· t
Si nota che quest'ultima è simile all'equazione di una retta:
y = y0 + α ·x
infatti il prodotto tra P0 e a è un valore costante poiché entrambi i termini sono costanti.
Pertanto, riportando su un sistema di assi cartesiani i valori della pressione Pt in funzione della temperatura in gradi Celsius t si ottiene una retta che incontra l'asse delle ordinate in P0 e l'asse delle ascisse alla temperatura di -273°C.
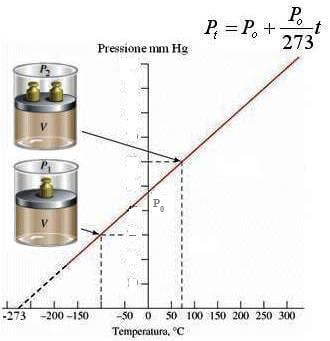
Rappresentazione grafica della legge di Gay-Lussac: in ascissa è riportata la temperatura in °C ed in ordinata la pressione
L'equazione:
![]()
può essere scritta anche nel seguente modo:
![]()
Ricordando che 273 + t = T in cui T = temperatura assoluta, si ha:
![]()
P0 è un valore costante che esprime la pressione del gas alla temperatura di 0°C, quindi il rapporto P0/273 è un valore costante.
Esprimendo la temperatura in Kelvin, la legge di Gay-Lussac afferma quindi che la pressione di un gas mantenuto a volume costante è direttamente proporzionale alla temperatura assoluta.
La relazione matematica tra Pt e T è quindi rappresentabile mediante una retta di pendenza V0/273:
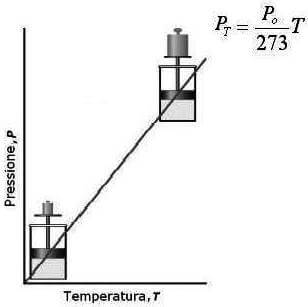
Rappresentazione grafica della legge di Gay-Lussac: in ascissa è riportata la temperatura assoluta ed in ordinata la pressione
In un piano pressione-volume la legge di Gay-Lussac è rappresentata invece da un segmento parallelo all'asse delle pressioni:
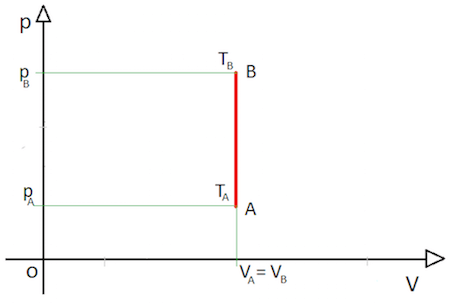
Esercizio
Una bombola di acciaio contiene biossido di carbonio alla temperatura di 30°C e alla pressione di 13,0 atm. Calcolare la pressione esercitata dal gas se si scalda la bombola fino alla temperatura di 80°C.
Svolgimento dell'esercizio
L'esercizio propone il calcolo della pressione di un gas mantenuto a volume costante quando la sua temperatura viene portata da 30°C a 80°C.
Siccome il gas viene mantenuto a volume costante possiamo applicare la legge di Gay-Lussac:
P1 : T1 = P2 : T2
Convertiamo le temperature in Kelvin sommando al valore della temperatura in gradi centigradi il valore 273 (approssimazione di 273,15):
T1 = 30 + 273 = 303 K
T2 = 80 + 273 = 353 K
Pertanto nel nostro caso si ha che:
P1 = 13,0 atm
T1 = 303 K
P2 = ?
T2 = 353 K
Sostituendo in modo opportuno i dati in nostro possesso, risulta che:
13,0 : 303 = P2 : 353
da cui:
P2 = 13,0 · 353 / 303 = 15,1 atm
Pertanto alla temperatura di 80°C la pressione del gas è pari a 15,1 atm.
Esercizi sulla legge di Gay-Lussac
Li trovi al seguente link: esercizi sulla legge di Gay-Lussac.
Esercizi sui gas
Li trovi online e svolti al seguente link: esercizi sui gas.
Link correlati:
Esercizio su una trasformazione isocora di un gas
Studia con noi