Anodo e catodo
Qual è la differenza tra anodo e catodo?
In un sistema elettrochimico l'individuazione dell'anodo e del catodo è spesso problematica poiché, come vedremo, talvolta il catodo corrisponde al polo positivo (+) e l'anodo al polo negativo (-), mentre altre volte si ha esattamente l'opposto.
In questa lezione, tramite semplici esempi e immagini illustrative, cercheremo pertanto di fare chiarezza su un importante argomento della chimica generale e della fisica. Daremo inizialmente una definizione generale di anodo e di catodo per poi intercalare questa definizione al caso delle pile e al caso delle celle galvaniche.
Definizione di anodo e di catodo
Anodo e catodo vengono definiti non in base alla polarità dell'elettrodo (+ o -) ma a seconda del tipo di processo che in esso avviene.
L'anodo (dal greco ἄνοδος = "salita"), è l'elettrodo nel quale avviene la semireazione di ossidazione, mentre il catodo (dal greco κάθοδος = "discesa") è l'elettrodo nel quale avviene la semireazione di riduzione (piccolo trucchetto per associare i termini: vocale con vocale - anodo, ossidazione - consonante con consonante - catodo, riduzione). Questa è una definizione generale che è sempre valida!
L'anodo e il catodo nelle pile
Nelle celle galvaniche, ovvero nelle pile, l'anodo è l'elettrodo sul quale avviene la semireazione di ossidazione e corrisponde al polo negativo (-) della pila.
Nella pila Daniell, ad esempio, l'anodo corrisponde all'elettrodo di zinco, in cui lo zinco metallico cede i propri elettroni trasformandosi nello ione Zn2+ (che passa in soluzione) secondo la semireazione: Zn → Zn2 + 2e−.
All'anodo c'è quindi produzione di elettroni che, per mezzo del circuito elettrico esterno, giungono sino al catodo nel quale vengono consumati (nel caso della pila Daniell dallo ione Cu2+ che si trova in soluzione e che si riduce a rame metallico secondo la semireazione Cu2+ + 2e− → Cu).

Nella pila Daniell (e nelle pile in generale), l'anodo corrisponde all'elettrodo negativo.
L'anodo e il catodo nelle celle elettrolitiche
Anche nelle celle elettrolitiche, secondo la definizione generale, l'anodo è l'elettrodo nel quale avviene la semireazione di ossidazione, mentre il catodo è l'elettrodo nel quale avviene la semireazione di riduzione.
Nel caso delle celle elettrochimiche, però, le reazioni di ossidazione e di riduzione vengono forzate per mezzo di un generatore di corrente; in questo caso quindi l'anodo è il polo positivo (+) mentre il catodo è il polo negativo (-).
Ad esempio, nell'elettrolisi del cloruro di sodio fuso, all'anodo, caricato positivamente, giungono gli ioni Cl− che danno la seguente semireazione di ossidazione:
Cl− → ½ Cl2 + e−
Al catodo, caricato negativamente per mezzo del generatore di corrente esterno, giungono invece gli ioni Na+ che danno la seguente semireazione di riduzione:
Na+ + e− → Na
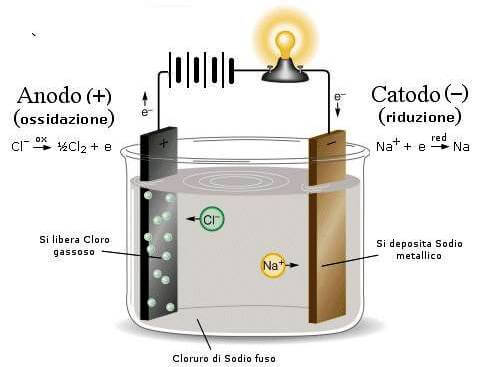
Nel processo di elettrolisi l'anodo corrisponde all'elettrodo positivo.
Concludiamo facendo notare che, rispetto ad una pila, in una cella elettrolitica i segni dell'anodo e del catodo sono invertiti.
Link correlati:
Che cos'è l'anodizzazione?
Studia con noi