Energia interna
L'energia interna di un sistema termodinamico
L'energia interna (U) di un sistema termodinamico è data dalla somma (∑) di tutte le energie, cinetica e potenziale delle particelle che lo compongono:
U = ∑(Ec + Ep)
Energia cinetica
L'energia cinetica (Ec) di una molecola, per esempio la molecola biatomica dell'idrogeno H2(g), è in realtà la somma di tre diversi contributi dovuti a tre diversi tipi di movimenti che la molecola può compiere:
a) energia cinetica traslazionale
L'energia cinetica traslazionale è dovuta al moto rettilineo della molecola dell'idrogeno considerata come massa puntiforme.
Si tratta di un moto caotico a causa dei continui urti della molecola contro le pareti del recipiente e contro le altre molecole di idrogeno.
b) energia cinetica di rotazione
L'energia cinetica di rotazione è dovuta alla rotazione della molecola attorno al suo centro di massa (o baricentro).
c) energia cinetica di vibrazione
L'energia cinetica di vibrazione è dovuta alla vibrazione dei due atomi di idrogeno rispetto al centro di massa. I due atomi, a causa della vibrazione, vengono a trovarsi ora più lontani, ora più vicini tra loro.
È ovvio che per una molecola monoatomica (He, Ar, Ne, ecc.) la molecola possiede solo energia di traslazione. Per una molecola triatomica, come ad esempio CO2, le vibrazioni sono invece più numerose.
L'energia cinetica complessiva di un sistema è dovuta al contributo di queste tre forme di energia cinetica ed è strettamente legata alla temperatura assoluta del sistema. Il valore medio dell'energia cinetica di un sistema di particelle monoatomiche è dato da:
![]()
in cui:
k = 1,3806 · 10-23 J/K
T = temperatura assoluta
L'energia cinetica media si chiama anche energia termica del sistema.
Energia potenziale
L'energia potenziale è energia di posizione.
Considerando una singola molecola, l'energia potenziale è dovuta alla posizione reciproca degli atomi che compongono la molecola, cioè alle forze di legame che tengono uniti gli atomi (legami intramolecolari).
Considerando più molecole, l'energia potenziale complessiva è dovuta non solo dall'energia potenziale delle singole molecole ma anche dalle forze attrattive che le une esercitano sulle altre, cioè alle forze dei legami intermolecolari.
L'energia potenziale di un sistema di molecole non è altro che l'energia chimica del sistema, ovvero la somma di tutte le energie dei legami presenti nel sistema.
Da tutto ciò ne deriva che l'energia interna di un sistema è energia termica + energia chimica.
U = ∑(Ec + Ep)
L'energia interna è un chiaro esempio di grandezza estensiva, cioè di grandezza il cui valore è proporzionale alla quantità di materia contenuta nel sistema, considerato in uno stato fisico ben determinato.
L'esistenza dell'energia interna è affermata dal primo principio della termodinamica nelle trasformazioni termodinamiche e viene interpretata tenendo presente la struttura discontinua della materia.
Se vogliamo inoltre calcolare la variazione dell'energia interna ΔU di un sistema, non ci dobbiamo preoccupare di sapere quale particolare trasformazione A→B è avvenuta, ma ci interessa conoscere unicamente i valori di UA e di UB. L'energia interna è infatti una funzione di stato e quindi la sua variazione dipende unicamente dal valore iniziale e dal valore finale di U. Si ha pertanto che: ΔU = UB - UA.
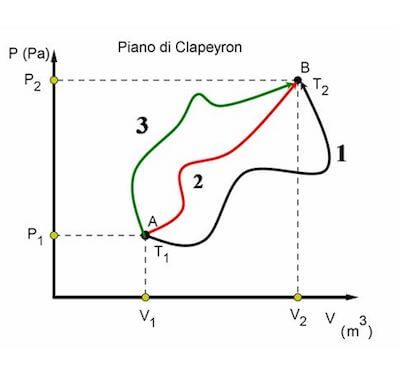
L'energia interna è una funzione di stato.
Energia interna e trasformazioni chimiche
Le trasformazioni chimiche sono sempre accompagnate dallo scambio tra queste due forme di energia. Infatti, nel corso di una reazione, avviene lo smantellamento delle molecole reagenti: gli atomi liberati si riassestano poi in modo diverso, stabilendo legami nuovi, quelli cioè dei prodotti della reazione.
Possono verificarsi due casi:
1) se i nuovi legami, nel loro complesso, contengono una minore quantità di energia potenziale rispetto ai vecchi legami, la quantità di energia potenziale eccedente si trasforma in energia cinetica, cioè in calore, che viene ceduto all'ambiente: si ha una reazione esotermica.
2) se i nuovi legami, nel loro complesso, contengono una maggiore quantità di energia potenziale rispetto ai vecchi legami, il sistema assorbe dall'ambiente energia termica (= cinetica) che si trasforma in energia potenziale (di legame): si ha una reazione endotermica.
Riassumendo
Si indica con il nome di energia interna quella parte dell'energia posseduta da un corpo che dipende solo dallo stato fisico intrinseco: essa dipende cioè dai moti e dalle posizioni reciproche delle particelle che costituiscono il corpo ed è quella che rimane escludendo l'energia cinetica e l'energia potenziale del corpo complessivo rispetto al riferimento esterno.
Fra le particelle costituenti la materia agiscono forze che comportano energia potenziale; tali particelle sono anche animate da moti di vibrazione, rotazione, traslazione che comportano energia cinetica; l'insieme di tali energie costituisce l'energia interna. L'energia interna è una grandezza estensiva e una funzione di stato.
Studia con noi