Legami Intermolecolari e forze di Van der Waals
Generalità e proprietà dei legami intermolecolari e forze di Van der Waals
Con il termine generico di legami intermolecolari si intendono le forze attrattive tra molecole.
Allo stato gassoso molto rarefatto le molecole sono dotate di elevata energia cinetica e sono indipendenti le une dalle altre.
Allo stato liquido e allo stato solido la situazione è decisamente diversa: in questi stati la maggior compattezza e la minor mobilità delle molecole è da imputarsi a interazioni tra esse. Tali interazioni riguardano sia molecole polari che molecole non polari e sono conosciute genericamente con il nome di forze di Van der Waals.
Le forze di Van der Waals sono interazioni molto deboli e hanno un'energia (0,1 - 10 kJ mol–1) che è mediamente cento volte inferiore a quella di un legame covalente o ionico (100 - 1000 kJ mol–1).
Le forze di Van der Waals hanno un breve raggio d'azione e la loro intensità diminuisce rapidamente all'aumentare della distanza.
Esistono tre tipi di forze di Van der Waals:
- interazione dipolo-dipolo
- interazione dipolo permanente-dipolo indotto
- interazione dipolo istantaneo-dipolo indotto (forze di London)
Un particolare tipo di interazione dipolo-dipolo è il:
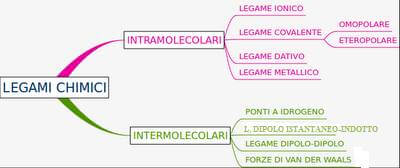
Classificazione dei legami chimici
Nei solidi molecolari e nei liquidi le intensità delle forze di Van der Waals sono generalmente maggiori all'aumentare della grandezza degli atomi e delle molecole coinvolte.
Ad esempio, man mano che il numero atomico dei gas nobili aumenta, aumenta anche la forze del legame di Van der Waals.
Ciò è dovuto al fatto che negli atomi più pesanti gli elettroni più esterni sono attratti meno fortemente dal nucleo e sono possibili dipoli istantanei e dipoli indotti più grandi.
Per questo motivo l'argon solido fonde a -184°C, temperatura di fusione considerevolmente più alta di quella dell'elio.
Quiz sui legami chimici
Se ti interessano li trovi qui: quiz sui legami chimici.
Link correlati:
Come possono essere classificati i solidi in base al tipo di legame chimico?
Studia con noi