Tavola Periodica di Mendeleev
La tavola periodica di Mendeleev e la scoperta della periodicità
I tentativi di ordinare gli elementi chimici in gruppi i cui componenti presentassero fra loro analogie furono molti: J. W. Doebereiner nel 1829 espose la teoria delle triadi. In tale teoria si raggruppavano elementi quali cloro, bromo, iodio o calcio, stronzio, bario, piuttosto simili.
Raggiunto nel 1858 con la regola di S. Cannizzaro un criterio sicuro per scegliere i pesi atomici, nel 1862 A. E. B. de Chancourtois ordinò gli elementi in base ai loro pesi atomici su una spirale, in modo che quelli simili si trovassero gli uni sotto gli altri, e nel 1864 J. A. R. Newlands enunciò la legge delle ottave.
Infine nel 1869 il chimico russo D. I. Mendeleev propose un sistema periodico degli elementi, cioè una classificazione degli elementi dalla quale emerge chiaramente la variazione periodica delle loro proprietà chimiche e fisiche allorché vengono ordinati secondo i valori crescenti del loro peso atomico. Il tedesco J. L. Meyer nell'anno successivo espose considerazioni sostanzialmente analoghe, utilizzando come criterio di elencazione le variazioni del volume atomico.
Pertanto, indipendentemente tra loro, Mendeleev in Russia e Meyer in Germania scoprirono che, se gli elementi chimici vengono ordinati in base alle loro masse atomiche crescenti, le loro proprietà sono periodiche cioè si ripetono con regolarità.
Sulla base di queste scoperte, nel 1869 Mendeleev mise a punto una tavola periodica dove tutti gli elementi fino ad allora noti erano ordinati in base alla loro massa atomica crescente. Talvolta questa regolarità era interrotta e pertanto lasciò spazi vuoti in attesa che questi elementi venissero scoperti.
Qualche anno più tardi furono scoperti il gallio e il germanio, elementi previsti da Mendeleev che andavano a riempire gli spazi vuoti della sua tabella periodica.
Il fatto che il sistema periodico venga oggigiorno attribuito al solo Mendeleev, origina dal fatto che egli pubblicò i risultati qualche mese prima di Meyer, ma il contributo di entrambi fu riconosciuto dalla Royal Society, che nel 1882 assegnò sia a Mendeleev che a Meyer la Davy Medal.
Lo schema di classificazione di Mendeleev era veramente sorprendente poiché lungo la stessa colonna si trovavano elementi aventi le stesse proprietà chimiche.
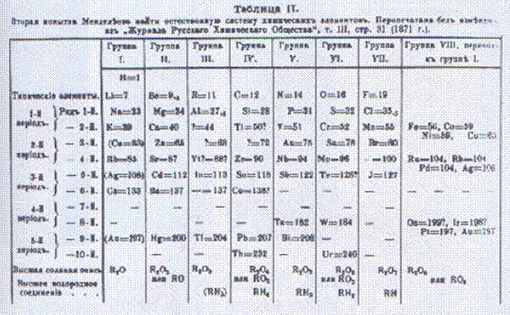
Successivamente B. Brauner (1899) aggiunse la sistema periodico il gruppo dei gas nobili (scoperti tra il 1894 ed il 1898 da R. G. Rayleigh e da G. Ramsay), e raggruppò gli elementi noti come lantanidi o lantanoidi.
La tabella di Mendeleev non riusciva però a spiegare alcune cose come il fatto che il cobalto, pur avendo una massa atomica maggiore di quella del nichel, possiede delle proprietà che porterebbero a collocarlo prima di questo elemento; lo schema di Mendeleev presentava infatti delle anomalie: si era così costretti, per tener conto delle proprietà degli elementi, a non seguire il criterio della progressività dei pesi atomici nel caso delle coppie Ar-K, Co-Ni e Te-I.
- Ti potrebbe interessare: test tavola periodica.
Nel 1913 G.J. Moseley capì che il parametro ordinatore degli elementi nella tavola periodica non era la massa atomica ma bensì il numero atomico; in tal modo la posizione del cobalto è proprio quella che precede il nichel. Fu quindi solo con i dati sulla struttura atomica che si poté stabilire che nel sistema periodico gli elementi si ordinano in funzione non del loro peso atomico, bensì del numero atomico crescente, cioè del numero degli protoni che esistono nel nucleo atomico di ciascun elemento chimico.
Negli anni seguenti si è finalmente giunti a fare piena luce sulla disposizione degli elementi nella tabella periodica e si è giunti a quella che viene definita la tavola periodica degli elementi.
La moderna tavola periodica
Il moderno sistema periodico pone in evidenza l'esistenza di elementi le cui proprietà fisiche (densità, potenziali di ionizzazione, volume atomico) e chimiche (valenza, elettropositività, ecc.) sono simili e compaiono a intervalli fissi e ricorrenti.
Queste somiglianze provengono da configurazioni elettroniche simili degli elettroni periferici e queste a loro volta sono in diretta correlazione col numero atomico dei rispettivi atomi. Ciò viene riassunto enunciando la legge periodica, la quale dice che le proprietà degli elementi sono funzioni periodiche dei loro numeri atomici.
Si considerino i gas nobili nel sistema periodico; essi hanno numero atomico 2, 10, 18, 36, 54 e 86 e ciascuno è inoltre immediatamente preceduto da elementi che hanno tutti proprietà simili (alogeni) e immediatamente seguito da elementi che hanno pure proprietà simili (metalli alcalini).
Le serie di elementi che esistono fra un gas nobile e l'altro costituiscono i periodi della classificazione ed è la disposizione di questi periodi di elementi in righe orizzontali l'una sopra l'altra che dà origine alla tabella periodica. Pertanto le colonne verticali che così si ottengono raggruppano elementi che hanno tutti proprietà simili e costituiscono i gruppi del sistema periodico.
Il primo periodo, detto anche "periodo molto piccolo", contiene soltanto due elementi, l'idrogeno e l'elio. Il secondo e il terzo periodo, detti anche primo piccolo periodo e secondo piccolo periodo, contengono ciascuno otto elementi che vanno rispettivamente dal litio al neo e dal sodio all'argo.
Il quarto, quinto e sesto periodo, detti anche primo, secondo e terzo grande periodo, contengono 18 elementi, dal potassio al kripton e dal rubidio allo xenon i primi due periodi, e 32 elementi il terzo (dal cesio al radon).
I numeri degli elementi contenuti nei successivi periodi stanno fra loro come la serie dei doppi dei quadrati dei numeri naturali (2xn2). Il settimo periodo, detto anche quarto grande periodo, si inizia con il francio (numero atomico 87) e termina ora con l'elemento di numero atomico 105 (nome proposto: dubnio).
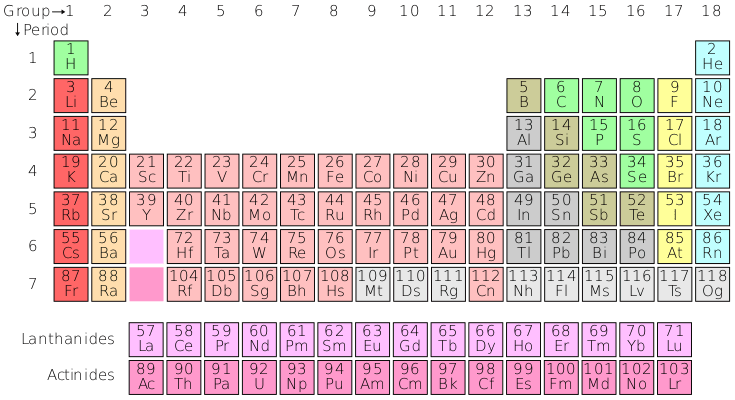
Si chiamano elementi di transizione quelli che nel sistema periodico stanno a metà dei grandi periodi e compaiono, nel primo grande periodo, con l'elemento di numero atomico 21 (scandio) e nei periodi successivi con l'ittrio (numero atomico 39), il lantanio (numero atomico 57) e l'attinio (numero atomico 89): in essi i successivi elettroni anziché disporsi nello strato orbitale più esterno si inseriscono in quello immediatamente più interno provocando alle volte la comparsa del paramagnetismo, la colorazione degli ioni e la variabilità della valenza.
Infine, con l'elemento lantanio di numero atomico 57 si inizia nel terzo grande periodo (il primo a contenere 32 elementi) una famiglia di 14 elementi, oltre al lantanio (18 + 14 = 32), straordinariamente simili fra loro, detti elementi delle terre rare o serie lantanidica: in essi i successivi elettroni vanno a occupare orbite ancora più interne e la somiglianza della struttura elettronica più esterna giustifica la somiglianza delle proprietà.
Analogo fenomeno si ripete nel quarto grande periodo dopo l'elemento attinio di numero atomico 89, che costituisce l'inizio della serie attinidica, alla quale appartengono quindi, oltre agli elementi attinio, torio, protoattinio e uranio, tutti i transuranici fino al laurenzio (intendendosi per transuranici gli elementi a numero atomico oltre il 92).
Valenza
Quanto alle proprietà comuni dei gruppi del sistema periodico, per limitarsi alla sola variazione della valenza, si dirà che essa ha valore uguale al numero progressivo del gruppo di appartenenza dei rispettivi elementi per i composti ossigenati, mentre nei composti con l'idrogeno la valenza sale da 1 a 4 dal primo al quarto gruppo, per ridiscendere da 4 a 1 dal quarto al settimo gruppo. La somma della valenza massima verso l'ossigeno e di quella verso l'idrogeno nei gruppi dal quarto al settimo rimane uguale a 8.
Link correlati:
Vuoi sapere quanti sono gli elementi della tavola periodica?
Tavola periodica con configurazione elettronica di tutti gli elementi chimici
Che cos'è la tabella chimica?
Elenco alfabetico e per numero atomico degli elementi chimici
Che cosa sono i blocchi della tavola periodica?
Studia con noi