Natura del solvente e solubilità
Influenza della natura del solvente sulla solubilità di un sale
I sali, essendo compoti ionici, sono poco solubili in solventi apolari o leggermente polari. Infatti la loro solubilizzazione è dovuta a due processi:
- allontanamento degli ioni presenti nel reticolo cristallino ad opera di un solvente avente costante dielettrica elevata
- solvatazione degli ioni formati
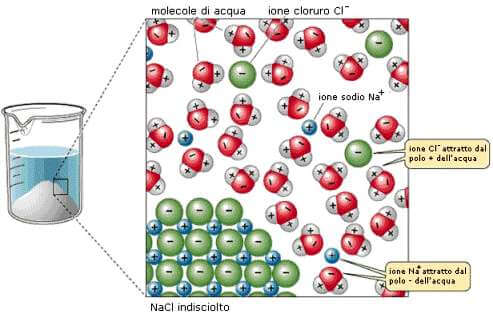
Processo di dissoluzione del cloruro di sodio NaCl.
Il processo di solubilizzazione dipende quindi dalla natura chimica sia del solvente che del soluto, nel senso che la solubilità di una qualunque sostanza dipende dalla natura dei legami intermolecolari e intramolecolari che la caratterizzano e dalla natura dei legami chimici che essa è in grado di stabilire con il suo solvente.
Una regola generale della solubilità indica che i simili sciolgono i simili. In altre parole, i solventi non polari come benzina, trielina e tetracloruro di carbonio sciolgono composti formati da molecole non polari (per esempio naftalina e iodio).
I solventi polari (acqua, alcol etilico) sciolgono bene molecole polari come lo zucchero. In particolare l'acqua scioglie bene anche solidi ionici come NaCl.
I liquidi formati da molecole polari (solventi polari) risultano ottimi solventi di molecole polari o di solidi ionici. Acqua ed etanolo, per esempio, sono solubili l'uno nell'altro e in tutte le proporzioni poiché sono entrambi liquidi polari con legami intermolecolari a idrogeno.
Quando essi si mescolano, tali legami vengono sostituiti da legami dello stesso tipo, ma fra solvente e soluto:
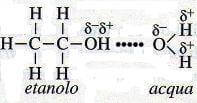
I liquidi formati da molecole non polari (solventi non polari) sono buoni solventi di liquidi e solidi a loro volta non polari. I grassi ad esempio sono solubilizzati solo da solventi non polari, quali benzina, trielina, tetracloruro di carbonio, ecc..
Ne deriva che la solubilità dei composti ionici poco solubili in acqua risulta ancora più bassa in solventi meno polari dell'acqua.
È questo il motivo per cui ad esempio, per effettuare la precipitazione del Ca2+ o del Sr2+ come solfati, solitamente si opera in presenza di alcol etilico che, presentando una costante dielettrica (ε = 28) più piccola di quella dell'acqua (ε = 78,5) ha un minore potere solubilizzante.
Link correlati:
costante dielettrica dell'acqua
Studia con noi