Ammoniaca
Proprietà e caratteristiche dell'ammoniaca.
Ammoniaca NH3 è una sostanza gassosa e tossica di odore intenso e penetrante che provoca la lacrimazione.
È presente in piccole quantità nell'atmosfera terrestre come prodotto di attività biologiche varie (fermentazioni, denitrificazione, ecc.) e della pirolisi dei combustibili fossili.
È spesso associata a manifestazioni vulcaniche a seguito di idrolisi dei nitruri presenti nelle rocce profonde.
L'ammoniaca e i suoi sali sono presenti anche nelle acque meteoriche e di superficie. Le acque sorgive contengono nitrati a causa di un processo ossidativo spinto dei sali ammonici previamente presenti.
Alla temperatura di 0°C e alla pressione di 1 atm la densità dell'ammoniaca vale 0,771 kg/m3.
Struttura dell'ammoniaca
All'ammoniaca gassosa si attribuisce una struttura a piramide trigonale, con gli atomi dell'idrogeno disposti ai vertici della base e l'atomo di azoto situato ad una distanza di 0,360 Å dal piano di base.
La distanza N-H è di 1,017 Å (101,7 pm) e l'angolo H-N-H vale 107,8°.
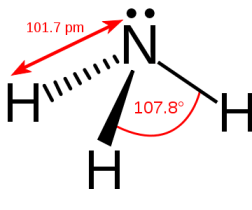
Formula chimica dell'ammoniaca e struttura della molecola.
L'atomo di azoto oscilla continuamente tra due posizioni simmetriche rispetto al piano degli atomi di idrogeno, essendo molto debole (6 Kcal) la barriera di potenziale che si oppone a tale oscillazione.
Proprietà fisiche e chimiche dell'ammoniaca
In condizioni normali l'ammoniaca è una gas incolore, di odore intenso penetrante che provoca la lacrimazione.
È molto solubile in acqua: la dissoluzione è accompagnata da un aumento di volume e sviluppo di calore. Il calore di soluzione di 1 mole di ammoniaca in 400 moli di acqua è 8,43 Kcal.
Le soluzioni acquose di ammoniaca conducono l'elettricità e hanno reazione alcalina. Questo porta ad ammettere che si verifichi l'equilibrio:
NH3 + H2O ⇄ NH4OH ⇄ NH4+ + OH−
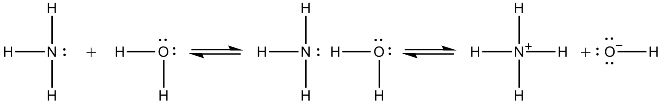
in cui la concentrazione di NH4OH dovrebbe coincidere con quella di NH3. In realtà si è trovato che esiste anche il seguente equilibrio di coordinazione:
NH3 + H2O ⇄ NH3·H2O
L'ammoniaca si decompone negli elementi che la costituiscono sotto l'effetto del calore, di radiazioni luminose o di scariche elettriche. La reazione di decomposizione non è mai completa ed è inoltre caratterizzata dall'alta reattività dei prodotti (idrogeno e azoto).
Con l'ossigeno e con l'aria, l'ammoniaca forma miscele tonanti; i limiti di esplosività delle rispettive miscele sono riportati nella seguente tabella:
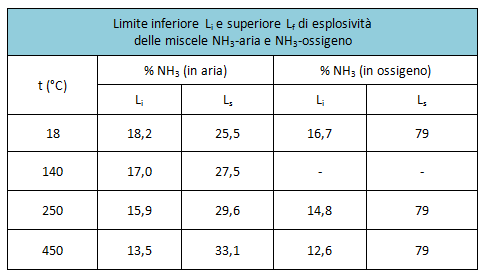
Le reazioni di ossidazione in fase gas conducono a prodotti diversi, a seconda delle modalità seguite, per esempio:
4 NH3 + 3 O2 → 2 N2 + 6 H2O
4 NH3 + 4 O2 → 2 N2O + 6 H2O
4 NH3 + 5 O2 → 4 NO + 6 H2O
L'ultima di questa serie di reazioni è quella su cui si basa il processo di produzione dell'acido nitrico: essa è termodinamicamente sfavorita ma viene esaltata dall'uso di opportuni catalizzatori.
Anche in soluzione acquosa l'ammoniaca può essere ossidata da ossidanti energici, per esempio permanganato di potassio. La relativa reazione:
NH3 + 2 KMnO4 → Mn2O3 + KNO3 + KOH + H2O
ha importanza storica essendosi ad essa fatto ricorso in Francia durante le guerre napoleoniche per la produzione di nitrato di potassio per munizioni.
Con il carbone, l'ossido di carbonio e gli idrocarburi, l'ammoniaca reagisce a caldo secondo le equazioni chimiche:
2 NH3 + C → NH4CN + H2
NH3 + CO → HCN + H2O
2 NH3 + 2 CH4 + 3 O2 → 2HCN + 6 H2O
Le ultime due reazioni vengono catalizzate, rispettivamente da diversi ossidi e dal platino.
L'ammoniaca è capace di legarsi a numerose sostanze, dando composti di addizione. Alcuni di questi hanno una debole energia di legame e non presentano un rapporto costante tra il numero di molecole di ammoniaca e quello del composto addizionato: essi si indicano con il nome di "ammoniati" per sottolineare l'analogia con gli idrati.
Altri composti possiedono invece una più forte energia di legame e presentano una certa regolarità nel rapporto molare tra l'ammoniaca e il metallo del sale addizionato. Per esempio, è nota a tutti una serie di composti d'addizione tra sali d'argento e ammoniaca, in cui il rapporto Ag/NH3 è = ½, mentre gli analoghi dei metalli bivalenti, come nichel, cadmio, zinco, ecc., presentano un rapporto = ¼, quelli del ferro e del cobalto trivalente hanno rapporto = ⅙, e così via.
La suddetta classe di composti è intermedia tra quella degli "ammoniati" e quella dei composti di coordinazione, nei quali lo ione metallico Mn+ perde completamente le sue caratteristiche entrando a far parte del catione complesso di una metallammina [M(NH3)m]n+ avente la stessa valenza del metallo in questione, con m = 2, 4, 6.
La formazione di suddetti composti spiega la solubilità in ammoniaca acquosa di idrossidi [Zn(OH)2, Cu(OH)2, Ni(OH)2, ecc.] e di sali (AgCl, Ag3PO4, ecc.) insolubili in acqua.
Le analogia tra ammoniaca ed acqua, di cui si è visto un esempio negli "ammoniati" sopra citati, trovano notevoli conferme nelle proprietà dell'ammoniaca liquida: questa, come l'acqua, conduce la corrente e si deve pertanto ammettere che esista un equilibrio ionico del tipo:
NH3 ⇄ H+ + NH2−
A seguito della solvatazione completa del protone, il suddetto equilibrio diventa:
NH3 ⇄ NH4+ + NH2−
la cui costante, che è 1,9 · 10-33 ha lo stesso significato del prodotto ionico dell'acqua. Il catione ammonio NH4+ caratterizza la funzione acida (H3O+ nel caso dell'acqua) , l'anione ammidico NH2− la funziona basica (OH− nel caso dell'acqua).
Anche le reazioni a caldo tra ammoniaca e metalli alcalini o metalli alcalino terrosi richiamano quelle corrispondenti con l'acqua, per esempio:
2 Na + 2 H2O → 2 NaOH + H2
2 Na + 2 NH3 → 2 NaNH2 + H2
La seconda delle due reazioni è utilizzata per la preparazione della sodioammide, che trova impieghi nella produzione del cianuro di sodio e come condensante in molte sintesi organiche.
Ricerca qualitativa dell'ammoniaca
La ricerca qualitativa dell'ammoniaca è eseguita tramite il reattivo di Nessler.
Usi dell'ammoniaca
L'utilizzo più importante dell'ammoniaca è quello legato alla sintesi dell'acido nitrico.
Di seguito vengono elencati alcuni degli altri campi di applicazione:
- nella sintesi di nitroderivati per l'industria degli esplosivi;
- in tintoria e conciaria;
- come fluido per impianti frigoriferi;
- come solvente nella sintesi organica;
- come solvente nell'industria cartaria;
- come detergente in ambito domestico;
- per la produzione di fibre sintetiche;
- nella produzione di sigarette;
- come agente stabilizzante dei lattici nell'industria della gomma;
- in campo farmaceutico per la sintesi di svariati farmaci.
Link correlati:
L'NH3 è una base forte o debole?
Studia con noi