Catalizzatore
Influenza di un catalizzatore sulla velocità di una reazione chimica
I catalizzatori sono sostanze che, aggiunte in piccole quantità ad una reazione chimica, modificano il valore della velocità di reazione senza venir consumati durante la reazione stessa, non compaiono nelle equazioni globali di reazione e non provocano variazioni del valore della costante di equilibrio.
I catalizzatori possono essere distinti in due categorie: catalizzatori positivi e catalizzatori negativi.
I primi aumentano la velocità di reazione, mentre i secondi la diminuiscono (e sono pertanto chiamati anche inibitori).
Come agisce un catalizzatore?
I principi di funzionamento dei catalizzatori sono vari e non sempre chiari: in linea di massima i catalizzatori permettono alle molecole di reagire secondo un meccanismo diverso, più conveniente (o meno conveniente se si tratta di inibitori) dal punto di vista energetico.
I catalizzatori positivi offrono un percorso di reazione diverso per il quale l'energia di attivazione è inferiore rispetto a quella della reazione non catalizzata.
In altre parole il catalizzatore non fa avvenire lo stesso atto reattivo con energia di attivazione minore, ma fa volgere la reazione chimica per una via diversa, cioè con reazioni intermedie diverse, per le quali è richiesta un'energia di attivazione minore.
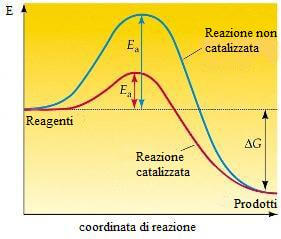
Il catalizzatore fornisce un percorso di reazione con una energia di attivazione inferiore rispetto alla reazione non catalizzata.
Come risulta dalla figura precedente, nella reazione catalizzata l'energia di attivazione risulta essere inferiore al valore dell'energia di attivazione della reazione non catalizzata e pertanto un maggior numero di molecole si trova a possedere una energia tale da poter superare il valore dell'energia di attivazione.
Va notato infine che i reagenti e i prodotti sono gli stessi della reazione non catalizzata e che il catalizzatore, pur partecipando alla reazione chimica, non viene consumato.
In una reazione chimica catalizzata, il catalizzatore può esistere o in unica fase con i reagenti (ad esempio catalizzatore solubile in una reazione che avviene in soluzione) ed in tal caso si parla di catalisi omogenea o catalisi di trasporto, oppure può esistere in una fase a sé (ad esempio catalizzatore solido in una reazione fra gas), ed in tal caso si parla di catalisi eterogenea o catalisi di contatto.
La catalisi eterogenea è assai delicata per la facilità di avvelenamento del catalizzatore: questo inconveniente non si riscontra nella catalisi omogenea.
Link correlati:
Test e quiz cinetica chimica
Esercizio sullo studio della coordinata di reazione di una generica reazione chimica
Che cosa sono gli inibitori della corrosione?
Studia con noi