Doppio legame carbonio-carbonio
Teoria VB e il doppio legame C=C
I doppi legami carbonio-carbonio sono legame tipici degli alcheni.
L'alchene più semplice è l'etilene con formula C2H4.
L'etilene è un composto in cui due atomi di idrogeno sono legati a ciascun atomo di carbonio con legami covalenti semplici, mentre i due atomi di carbonio sono legati tra loro da due legami covalenti (doppio legame).

La rappresentazione dell'etilene così descritta è soddisfacente, in quanto rispetta la regola che ciascun atomo di carbonio debba avere attorno a sé , nel guscio più esterno, otto elettroni e ciascun atomo di idrogeno ne debba avere due (regola dell'ottetto).
Approccio quanto-meccanico
La teoria del legame di valenza interpreta la formazione del legame covalente utilizzando il concetto quantomeccanico di orbitale.
È in base a questa teoria che spiegheremo la formazione dei legami nella molecola dell'etilene.
Come è possibile notare nella figura precedente, nell'etilene, ogni atomo di carbonio è legato ad altri tre atomi ed è pertanto ibridato sp2.
Questa ibridazione si ottiene mescolando un orbitale 2s con due orbitali 2p (ad esempio gli orbitali 2px e 2py); ne risultano così tre orbitali ibridi sp2 disposti su un unico piano a 120° l'uno dall'altro.
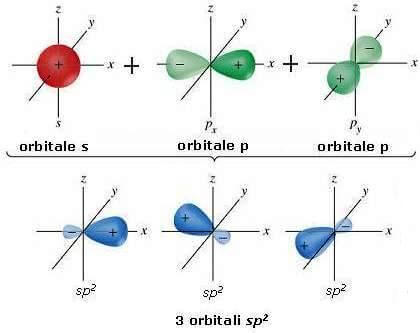
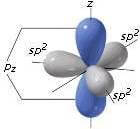
L'orbitale 2pz non coinvolto nell'ibridazione è disposto perpendicolarmente al piano formato dai tre orbitali ibridi sp2
Ciascun atomo di carbonio forma due legami C―H. Ognuno dei due legami C―H si ottiene per sovrapposizione di un orbitale sp2 del carbonio con l'orbitale 1s di ciascun atomo di idrogeno.
Il doppio legame C=C, invece, si realizza in seguito alla sovrapposizione frontale tra due orbitali ibridi sp2 (legame σ) e alla sovrapposizione laterale tra i 2 orbitali 2pz non coinvolti nell'ibridazione (legame π):
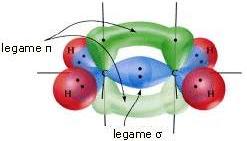
La sovrapposizione laterale dei due orbitali 2pz è meno efficace della sovrapposizione frontale che si ha in nel legame σ; per tale ragione un legame π è più debole di un legame σ.
Il doppio legame carbonio-carbonio è pertanto composto di un forte legame σ (circa 100 Kcal/mol di energia di legame) e di un più debole legame π (circa 45 Kcal/mole).
La forza totale di un doppio legame carbonio-carbonio è dunque 145 Kcal/mol, maggiore di quella di un singolo legame carbonio-carbonio (circa 83 Kcal/mol).
A causa di questa maggiore forza di legame la distanza carbonio-carbonio è più bassa nell'etilene che non nell'etano.
Inoltre, è a causa del legame π che la rotazione intorno al legame C=C è impedita; per tale motivo, alcuni tipi di alcheni opportunamente sostituiti possono dare isomeria cis-trans.
Da misure di diffrazione elettronica e spettroscopiche risulta che nel doppio legame carbonio-carbonio:
- gli angoli di legame C―C―H sono di 121,3°;
- gli angoli di legame H―C―H sono di 117,4°;
- la lunghezza di legame C―C è di circa 1,34 Å (nell'etano la distanza di legame C―C è 1,54 Å);
- la lunghezza di legame C―H è di circa 1,09 Å (nell'etano 1,10 Å).

Studia con noi