Energia di legame
Definizione di energia di legame
Nelle molecole (o nelle sostanze ioniche) gli atomi (o gli ioni) sono tenuti insieme da vari tipi di legame che, a seconda della loro natura, possono essere classificati in:
1) legami covalenti che si formano per la messa in comune di elettroni appartenenti agli orbitali esterni degli atomi coinvolti;
2) legami elettrostatici che si formano fra ioni o molecole elettricamente cariche;
3) legami metallici che si instaurano fra ioni positivi immersi in una nuvola elettronica uniformemente distribuita.
In ogni legame chimico gli atomi sono tenuti insieme da una certa energia, chiamata energia di legame, che può essere misurata rilevando l'energia minima necessaria per rompere il legame stesso (energia di dissociazione).
La conoscenza delle energie di legame, oltre a fornirci una diretta informazione circa la stabilità del legame stesso, è utile per stabilire i bilanci energetici di una reazione chimica.
Consideriamo il caso dell'elettrolisi dell'acqua: facendo passare corrente nell'acqua, resa buona conduttrice con l'aggiunta di un sale ionico, essa si scinderà nei suoi elementi costituenti: idrogeno e ossigeno (che appena formati assumono la forma molecolare unendosi a due a due) secondo la reazione:
2H2O → 2H2 + O2
Nel corso della reazione i legami covalenti O-H si rompono per poi formare i legami H-H e O-O nelle molecole H2 e O2.
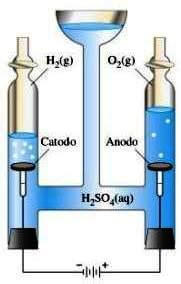
Elettrolisi dell'acqua.
Perché essa avvenga occorre fornire energia (elettrica in questo caso), dato che l'energia necessaria per rompere i legami dell'acqua è superiore a quella che viene rilasciata quando si formano i nuovi legami HH e O-O.
L'energia di un legame è funzione della forza con cui gli atomi sono legati, che a sua volta dipende dal tipo di atomi coinvolti e dalla distanza tra di essi.
Che cos'è l'energia di legame?
L'energia di legame tra due atomi è l'energia necessaria per rompere il legame che li unisce; essa viene espressa in kilojoule per mole (kJ · mol-1), anche se non è raro trovarla espressa in kilocalorie per mole (1 kcal = 4,184 kJ) o in elettronvolt per mole (1eV · mol-1 = 23,06 kcal = 96,5 kJ).
L'ordine di grandezza delle energia dei legami chimici va da pochi kJ a molte centinaia di kJ per mole di legami.
Come rappresentato nel grafico qui di seguito, l'energia di legame può essere anche intesa come l'energia necessaria per portare i due atomi dalla distanza di legame ad una distanza infinita, ovvero l'energia necessaria per separare i due atomi legati.
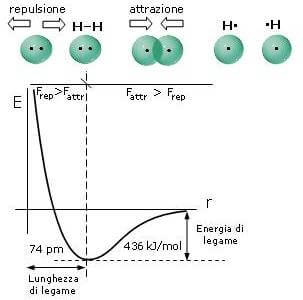
Andamento dell'energia potenziale durante la formazione di un legame covalente tra due atomi di idrogeno.
Come è possibile notare dal grafico precedente, per H2 l'energia di legame (corrispondente al processo H2 → H + H) è di 436 kJ · mol-1.
Energia di legame dei principali legami chimici
Di seguito vengono indicati i valori dell'energia di legame (in kJ · mol-1) dei principali legami chimici.
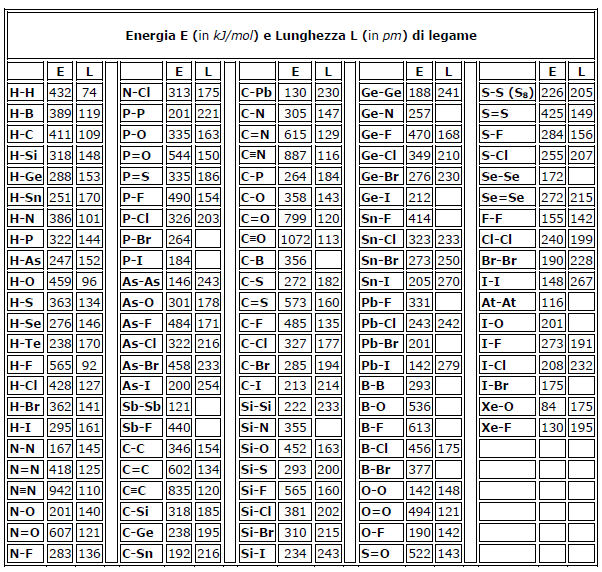
Nella tabella sono riportate le energie di legame, in kJ/mol, per alcuni legami più comuni.
L'affermazione che l'energia di un certo legame A-B ha un dato valore, ad esempio che il legame O-H ha una energia di legame di 459 kJ · mol-1 è corretta solo in prima approssimazione: infatti il valore dell'energia di legame fra due atomi dipende non soltanto dalla natura di questi, ma anche dalla natura di altri atomi eventualmente legati ad essi.
Media geometrica della energia di legame
Si è detto che il valore dell'energia di un legame è misurato dall'energia necessaria per rompere il legame stesso; per le energie di legami covalenti puri (nei quali cioè non esiste una componente elettrostatica) esiste un postulato della media geometrica della energia di legame in base al quale l'energia di un legame atomico A-B può essere calcolata come media geometrica fra le energie del legame A-A e del legame B-B nelle molecole A2 e B2.
I dati così ottenuti sono tanto più in accordo con i dati sperimentali quanto meno differiscono i valori delle energie dei due legami A-A e B-B. Consideriamo ad esempio la reazione di formazione del cloruro di idrogeno dagli elementi:
H2 + Cl2 → 2 HCl
Secondo il predetto postulato, il valore dell'energia del legame H-Cl, in assenza di azioni elettrostatiche, sarebbe dato dalla media geometrica fra i valori delle energie dei legami H-H e Cl-Cl esistenti nelle molecole H2 e Cl2:
![]()
Determinazioni sperimentali danno invece, per il legame H-Cl (si veda tabella precedente), un valore di 428 kJ·mol-1: il surplus di energia nel legame (Δ = 428 -322 = 106 kJ·mol-1) viene attribuito all'attrazione elettrostatica fra la parte negativa e la parte positiva della molecola H-Cl (si ricordi infatti che il legame tra H e Cl in H-Cl è covalente polare, quindi l'energia di legame è dovuta sia al legame covalente che alla attrazione elettrostatica tra il cloro con carica parziale negativa e l'idrogeno con carica parziale positiva).
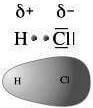
Legame covalente polare nella molecola dell'HCl.
Si noti che il valore Δ = 106 kJ·mol-1 va considerato come indicativo della esistenza di una componente elettrostatica nel legame covalente H-Cl, ma non come una misura esatta di questa. Infatti Δ è ottenuto come differenza fra un valore certo determinato sperimentalmente (428 kJ·mol-1) ed uno incerto (322 kJ·mol-1) calcolato in base al postulato della media geometrica, la cui validità diminuisce, come si è detto, con l'aumentare della differenza fra le energie dei due legami A-A e B-B.
Energia di legame ed elettronegatività
Misurando le energie di legame di molecole biatomiche si è potuta costruire una scala di elettronegatività degli elementi, cioè della loro maggiore o minore capacità di attrarre altri elettroni, seguendo un metodo dovuto a Linus Pauling. La forza di un legame è tanto maggiore quanto più elevata è la differenza di elettronegatività degli atomi coinvolti.
Link correlati:
Che cos'è e come si forma il legame ionico?
Qual è l'unità di misura dell'energia?
Studia con noi