Pressione parziale
Definizione e spiegazione della pressione parziale
I gas sono miscibili tra loro in tutte le proporzioni formando miscugli omogenei. Se due o più gas vengono mescolati in un recipiente, secondo la legge di Dalton, ogni componente del gas si comporta come se fosse l'unico presente all'interno del recipiente esercitando una pressione detta pressione parziale.
Definizione di pressione parziale
La pressione parziale di un gas in una miscela gassosa è pertanto la pressione che esso eserciterebbe qualora occupasse da solo, alla stessa temperatura, il volume occupato dalla miscela gassosa.
Sempre secondo la legge di Dalton, quando due o più gas (inerti tra loro e dal comportamento ideale) vengono mescolati in unico recipiente, la pressione totale esercitata dalla miscela gassosa è uguale alla somma delle pressioni parziali dei singoli gas.
Pertanto:
![]()
Per comprendere meglio il concetto di pressione parziale consideriamo due gas diversi (H2 e He) all'interno di un recipiente del volume di 5 litri e alla temperatura di 20°C; la pressione totale della miscela, così come riportato nella figura seguente, sia 8,4 atm.
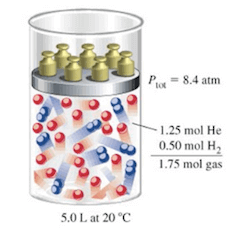
La pressione totale della miscela, nel recipiente del volume di 5 L e alla temperatura di 20°C, è 8,4 atm.
Considerando il solo He, se esso occupasse da solo il volume occupato dalla miscela gassosa alla stessa temperatura di 20°C, la sua pressione parziale sarebbe di 6,0 atm.
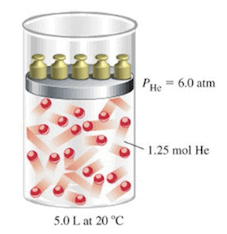
La pressione parziale di He è di 6,0 atm.
Viceversa, considerando il solo H2, se esso occupasse da solo il volume occupato dalla miscela gassosa alla stessa temperatura di 20°C, la sua pressione parziale sarebbe di 2,4 atm.
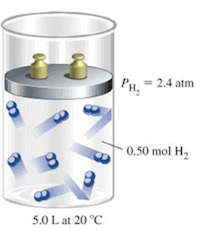
La pressione parziale di H2 è di 2,4 atm.
Come detto in precedenza, la pressione totale occupata dalla miscela gassosa è data dalla somma delle pressioni parziali dei singoli gas, infatti:
Ptot = PHe + PH2 = 6,0 + 2,4 = 8,4 atm
Calcolo della pressione parziale di un gas
Consideriamo una miscela di gas all'interno di un recipiente di volume V posto alla temperatura T.
Per ciascun gas presente nella miscela gassosa è applicabile l'equazione di stato dei gas perfetti; indicando con ni e Pi il numero di moli e la pressione parziale del componente imo e con V del recipiente, si ha che:
![]()
Dividendo membro a membro l'equazione precedente per l'equazione:
![]()
si ottiene:
![]()
Ricordando che il rapporto tra il numero di moli del componente imo e il numero di moli totali della miscela gassosa altro non è che la frazione molare del componente imo:
![]()
si ha che:
![]()
Pertanto: la pressione parziale di ciascuno dei componenti di una miscela gassosa è data dal prodotto della pressione totale per la frazione molare di quel componente.
Esercizio sul calcolo delle pressioni parziali di una miscela gassosa
Una miscela gassosa è costituita da 7,99 g di Ar, 0,4032 g di H2 e 1,60 g di He. Sapendo che, ad una certa temperatura, la pressione totale esercitata dalla miscela gassosa è di 2 atm, si determini la pressione parziale di ciascun gas.
Svolgimento dell'esercizio
Calcoliamo inizialmente le masse molari dei composti:
MM (Ar) = 39,95 g/mol
MM (H2) = 2,016 g/mol
MM (He) = 4,00 g/mol
Determiniamo il numero di moli di ciascun componente dividendo la massa in grammi per il valore della massa molare:
nAr = g / MM = 7,99 / 39,95 = 0,20 mol
nH2 = g / MM = 0,4032 / 2,016 = 0,20 mol
nHe = g / MM = 1,60 / 4,00 = 0,40 mol
Le moli totali della miscela gassosa sono:
ntot = 0,20 + 0,20 + 0,40 = 0,80 mol
Calcoliamo infine le frazioni molari di tutti i componenti dividendo il numero di moli di ciascun componente per il numero di moli totali:
a) Frazione molare di Ar:
XAr = 0,20 / 0,80 = 0,25
a) Frazione molare di H2:
XH2 = 0,20 / 0,80 = 0,25
a) Frazione molare di He:
XHe = 0,40 / 0,80 = 0,50
In base alla legge di Dalton la pressione parziale di ciascun componente della miscela gassosa è data dal prodotto della pressione totale (Ptot = 2 atm) per la frazione molare di quel componente (Xi). In formule:
PAr = Ptot · XAr = 2 · 0,25 = 0,5 atm
PH2 = Ptot · XH2 = 2 · 0,25 = 0,5 atm
PHe = Ptot · XHe = 2 · 0,50 = 1,0 atm
Naturalmente, come già detto più volte, la pressione totale della miscela gassosa è pari alla somma delle pressioni parziali dei singoli gas, infatti:
Ptot = PAr + PH2 + PHe = 0,5 + 0,5 + 1,0 = 2,0 atm
Esercizi sui gas
Li trovi online e svolti al seguente link: esercizi sui gas.
Studia con noi