Modello atomico di Bohr
Modello atomico di Bohr: definizione e spiegazione
In questa lezione vedremo cosa afferma il modello atomico proposto dal fisico danese Niels Henrik David Bohr (Copenaghen, 7 ottobre 1885 – Copenaghen, 18 novembre 1962).
Vedremo quali contributi Bohr diede alla comprensione della struttura atomica e quali studi indussero il fisico danese a ipotizzare il suo modello atomico.
Vedremo infine quali postulati sono alla base della sua teoria e perché la si ritenga oramai superato.
Nel 1913 gli studi sugli spettri di emissione e sugli spettri di assorbimento dell'idrogeno e di altre sostanze, indussero il fisico danese N. Bohr a pensare che gli elettroni si muovessero nello spazio soltanto in orbite circolari di ben definita energia (orbite stazionarie o livelli di energia).
Fino ad allora era ritenuto valido il modello atomico di Rutherford, ma questo modello non era in grado di interpretare gli spettri atomici di emissione e di assorbimento di molte sostanze.
Inoltre, se fosse stato valido tale modello atomico, l'elettrone ruotando attorno al nucleo doveva emettere energia elettromagnetica a scapito della sua energia cinetica, fino a precipitare sul nucleo stesso annulandosi.
In altre parole l'atomo, in un tempo quasi istantaneo, doveva perdere la sua stabilità.
Modello atomico di Bohr: postulati
Il modello atomico di Bohr , valido solo per l'atomo di idrogeno, si basa su due postulati innovativi.
Il primo postulato afferma che l'elettrone può percorrere attorno al nucleo alcune orbite circolari senza perdere energia. I raggi di tali orbite soddisfano tutti la relazione:
![]()
dove m è la massa dell'elettrone, v è la sua velocità, h è la costante di Planck. Al termine n, un numero intero che può assumere tutti i numeri interi maggiori di 1, Bohr diede il nome di numero quantico principale.
Tale equazione è possibile ottenerla stabilendo teoricamente che la condizione perché un elettrone muovendosi su un'orbita non emetta energia, sia cioè in uno stato stazionario, è che il valore del momento angolare dell'elettrone (mvr) che percorre l'orbita sia un multiplo intero della grandezza h/2p ovvero:
![]()
nella quale n = 1, 2, 3, ecc.
Questa condizione implica che il momento angolare dell'elettrone non può assumere tutti i valori possibili, ma soltanto alcuni e imporre questa limitazione significa quantizzare il momeno angolare.
Questo può variare perciò solo per quanti, multipli interi del valore minimo (h/2p).
Il secondo postulato afferma che l'energia assorbita da un elettrone ne consente la transizione dall'orbita in cui si trova normalmente (stato fondamentale), a una delle orbite di energia quantizzata superiore (stato eccitato).
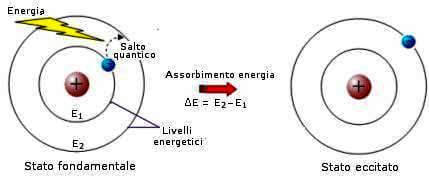
In queste orbite, l'elettrone permane per un tempo brevissimo (10-9 s), per poi ritornare allo stato energetico fondamentale.
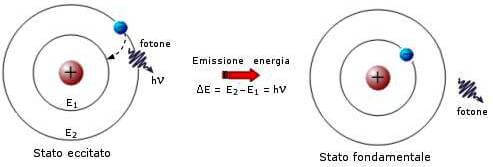
Un atomo allo stato eccitato non può pertanto tornare allo stato fondamentale liberando un fotone di qualsiasi frequenza, ma potrà soltanto emettere un fotone la cui energia è uguale alla differenza tra quelle dei due stati tra cui avviene la transizione.
Quantizzazione dei raggi delle orbite dell'atomo di idrogeno
Applichiamo il secondo principio della dinamica (F = m · a) all'elettrone (massa m, carica e) dell'atomo di idrogeno, che, si muove con moto uniforme (velocità v) su una circonferenza (raggio r) con centro nel nucleo: nel nostro caso la forza è l'attrazione coulombiana fra nucleo positivo ed elettrone negativo ed è data da F = e2/r2 (* vedi fondo pagina) e l'accelerazione è data dall'espressione a = v2/r.
Peranto è (F = m · a):
e2/r2 = m · v2/r
Ricavando dalla relazione
![]()
il valore di r2 e sostituendolo nella equazione e2/r2 = m · v2/r, si ottiene:
![]()
espressione nella quale non compare più la velocità dell'elettrone e che mostra come risultino quantizzati anche i raggi delle orbite dell'elettrone dell'atomo di idrogeno corrispondenti ai possibili stati stazionari. Poiché n può assumere solo valori interi 1, 2, 3, ... i corrispondenti valori di r, relativi ai primi tre valori, nel sistema CGS valgono:
n = 1 ; r = 12 ·(6,626 ·10-27)2 / [4 ·3,142 ·(9,11·10-28) ·(4,80·10-10)2] = 0,53 · 10-8 cm = 0,053 nm
n = 2 ; r = 22 · 0,053 = 0,212 nm
n = 3 ; r = 32 · 0,053 = 0,477 nm
Perciò l'unico elettrone presente nell'atomo di idrogeno potrà ruotare attorno al nucleo soltanto alle distanze 0,053 nm, 0,212 nm, 0,477 nm, ecc.
Le superfici sferiche corrispondenti a questi raggi sono stati stazionari e sono gli unici stati permessi per l'elettrone (normalmente l'elettrone ruota però sul primo stato stazionaio, n = 1).
Quantizzazione dell'energia dell'elettrone dell'atomo di idrogeno
Ad ogni orbita corrisponde un definito valore dell'energia dell'elettrone che la percorre, anche questa quantizzata.
L'elettrone (di carica -e) dell'atomo di idrogeno che percorre un'orbita (di raggio r) attorno al nucleo (di carica +e) possiede un'energia potenziale
Ep = - e2/r
ed una energia cinetica
Ec = m · v2/2
la quale, ricordando che
e2/r2 = m · v2/r
può scriversi
Ec = e2/2r
L'energia totale E dell'elettrone che si trova sullo stato stazionario di raggio r vale E = Ep + Ec, cioè:
![]()
Sostituendo a questa equazione il valore di r trovato in precedenza
![]()
essa diventa:
![]()
che esprime la quantizzazione dell'energia nell'atomo di H. Di conseguenza, poiché l'elettrone dell'atomo di idrogeno può possedere soltanto i valori di energia definiti dalla precedente equazione, se si fornisce energia all'elettrone che si trova ad esempio sullo stato stazionario caratterizzato da n = 1, essa potrà essere assorbita dall'elettrone solo se è sufficiente a far saltare l'elettrone dal primo stato stazionario ad uno successivo.
L'elettrone eccitato tende poi a tornare spontaneamente nello stato di minore energia (n=1) riemettendo di nuovo, sotto forma di radiazione, l'energia che aveva assorbito nell'eccitazione.
Determinazione delle frequenze emesse dall'atomo di idrogeno
A. Einstein (premio Nobel* nel 1921) aveva stabilito che ad una radiazione di frequenza v è associato un quanto di energia E (fotone) definito dalla relazione:
![]()
nella quale h è la costante di Planck. Tale relazione esprime il fatto che una radiazione manifesta la propria energia in modo discontinuo, ovvero per quanti di energia E e mostra la relazione fra il valore di questi e la frequenza della radiazione. Pertanto per fornire all'elettrone energia radiante è necessario servirsi di una radiazione di frequenza opportuna.
Nel passaggio dell'elettrone dell'atomo di idrogeno da uno stato eccitato, con numero quantico n2 ed energia E2 ad uno stato a minor contenuto di energia con numero quantico n1 (n1 < n2) ed energia (E1 < E2), si avrà una emissione di energia sotto forma di radiazione con frequenza che potremo scrivere:
![]()
Ricordando che:
![]()
si ha:
![]()
oppure, trasformando la frequenza in numeri d'onda:
![]()
in cui:
![]()
è la costante di Rydberg (R = 1,09737 · 107 m-1)
Dalle precedenti relazioni è possibile calcolare tutte le frequenze che l'atomo di idrogeno eccitato può emettere tornando allo stato fondamentale (spettro di emissione) o assorbire eccitandosi (spettro di assorbimento) per il salto dell'elettrone fra due dei possibili stati stazionari di numeri quantici n1 e n2.
* Il premio Nobel fu istituito dal chimico svedese Alfred Nobel.
Riassumendo
Bohr, in una serie di scritti, tra il 1913 e il 1915 sviluppa la sua teoria sulla costituzione degli atomi, applicando al modello atomico proposto da Rutherford la teoria quantizzata della radiazione di Planck e Einstein, introducendo, inoltre, come postulato ad hoc, quanto nel suo modello non era in accordo con l'elettromagnetismo e la meccanica classica.
I postulati di Bohr, per un atomo costituito da un elettrone ruotante attorno al nucleo, sono i seguenti:
1) Il sistema atomico possiede un numero di stati elettronici in cui non vi è emissione di radiazione; in essi, detti stati stazionari, l'elettrone percorre orbite stabili senza irradiare.
2) Ogni emissione o assorbimento di energia radiante corrisponde a una transizione tra due stati stazionari e quindi al passaggio dell'elettrone da un'orbita stabile a un'altra.
3) L'equilibrio dinamico del sistema negli stati stazionari è governato dalle ordinarie leggi di meccanica; esse non valgono per le trasmissioni da uno stato all'altro.
Nello stato stazionario vi è pertanto equilibrio tra forza centripeta e forza di attrazione elettrostatica verso il nucleo.
4) I possibili stati stazionari del sistema, consistente nell'elettrone che ruota a velocità v, su orbite circolari di raggio r, attorno al nucleo, sono legati alla quantizzazione del momento angolare dell'elettrone.
* La legge di Coulomb è data dalla relazione:
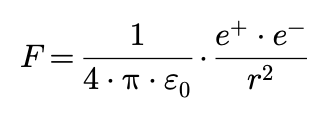
in cui:
- e+ ed e− sono i valori delle cariche elettriche;
- r è la distanza tra le due cariche elettriche;
- ε0 è la costante dielettrica assoluta.
Se si assume come carica elettrica unitaria quella che posta a 1 cm di distanza, nel vuoto, da una carica elettrica uguale che la respinge con la forza di 1 dina, la legge di Coulomb diventa: F = e2/r2.
In questa unità di carica elettrostatica (assoluta) la carica dell'elettrone vale 4,80 · 10-10 ues; ricordando infine che 1 coulomb = 3 · 106 ues risulta che essa vale anche 1,60 · 10-19 coulomb.
Quiz sull'atomo
Se ti interessano li trovi qui: quiz sull'atomo.
Link correlati:
Che cosa sono le regole di selezione?
Che cosa sono le orbite ellittiche?
Che cos'è la meccanica razionale?
Studia con noi