Legge di Boyle
Enunciato e spiegazione della legge di Boyle
Robert Boyle, studiando le proprietà fisiche dell'aria, verificò che esiste una relazione ben precisa tra il volume di un certo campione di aria mantenuto a temperatura costante e la pressione alla quale esso viene sottoposto.
Nel 1662 Robert Boyle formulò pertanto la legge dell'isoterma, nota anche come legge di Boyle: il volume occupato da un gas, mantenuto a temperatura costante, è inversamente proporzionale alla pressione alla quale il gas è sottoposto.
Ciò vuole dire che, mantenendo costante la temperatura (trasformazione isoterma) e raddoppiando, triplicando o quadruplicando,ecc. la pressione esercitata sul gas, il suo volume diventa rispettivamente un mezzo, un terzo, un quarto. ecc.
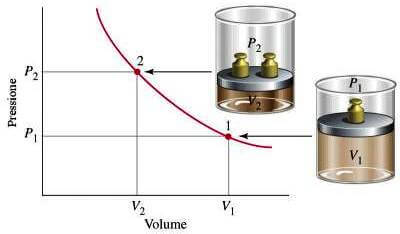
Rappresentazione grafica della legge di Boyle: per un gas mantenuto a temperatura costante, al raddoppiare della pressione il volume del gas dimezza. La curva che ne deriva è un iperbole equilatera ed è, evidentemente, una isoterma.
Formula della legge di Boyle
In termini matematici, la legge di Boyle può essere scritta nel seguente modo:
P · V = k
Infatti, a temperatura costante, P e V sono inversamente proporzionali e quindi il loro prodotto è una costante. Scrivere P · V = k significa anche scrivere (per due generici stati che indichiamo con i pedici 1 e 2):
P1 · V1 = P2 · V2
che è un altro modo di rappresentare matematicamente la legge di Boyle. In essa:
- P1 e V1 sono rispettivamente la pressione e il volume iniziali;
- P2 e V2 sono rispettivamente la pressione e il volume finali.
In un sistema di assi cartesiani la curva che si ottiene ponendo i valori (calcolati alla medesima temperatura) del volume in ascissa e della pressione in ordinata, è una iperbole equilatera detta isoterma; diminuendo la temperatura l'isoterma si sposta verso l'interno:
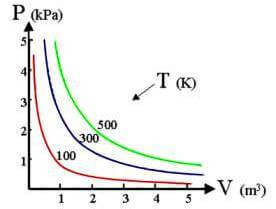
Rappresentazione grafica della legge di Boyle.
Condizioni di validità della legge di Boyle
La legge di Boyle è valida per gas che sperimentalmente hanno un comportamento simile a quello di un gas ideale, oppure per gas che si trovano in condizioni di pressione sufficientemente basse da essere considerati rarefatti e temperature non troppo vicine alla temperatura di liquefazione.
La legge di Boyle spiegata da un punto di vista microscopico
Per spiegare la legge di Boyle da un punto di vista microscopico, dobbiamo ricordare che l'energia cinetica delle particelle di un gas dipende dalla temperatura e che, mantenendo costante la temperatura, l'energia cinetica delle particelle rimane costante.
La pressione di un gas dipende invece sia dall'energia cinetica delle particelle sia dalla frequenza degli urti contro le pareti del recipiente. Siccome, a temperatura costante, l'energia cinetica delle particelle rimane costante, l'unico fattore che determina la pressione di un gas è la frequenza degli urti contro le pareti del recipiente.
Dimezzando il volume occupato dal gas, il numero totale delle particelle resta lo stesso ma raddoppia il loro numero nell'unità di volume: per tale motivo la frequenza degli urti raddoppia e quindi raddoppia anche la pressione del gas.
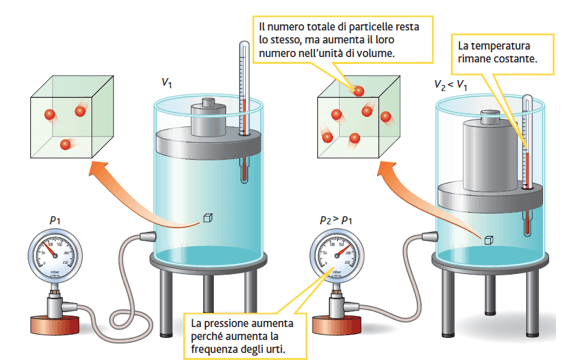
Secondo la legge di Boyle, a temperatura costante, un aumento di pressione esercitata su una massa di gas comporta una diminuzione del suo volume.
Esercizio #1
Una certa quantità di azoto, alla pressione di 2,0 atm, occupa il volume di 0,8 L. Calcola il volume occupato dal gas se la pressione viene portata a 5,0 atm mantenendo costante la temperatura.
Svolgimento dell'esercizio
L'esercizio propone il calcolo del volume di un gas (azoto) che, mantenuto a temperatura costante, viene compresso e la sua pressione passa da 2,0 atm a 5,0 atm.
Siccome la temperatura del gas rimane costante, possiamo applicare a legge di Boyle:
P1 · V1 = P2 · V2
in cui:
- P1 = 2,0 atm
- V1 = 0,8 L
- P2 = 5,0 atm
- V2 = ?
Sostituendo in modo opportuno i dati a nostra disposizione, si ha che:
2,0 · 0,8 = 5,0 · X
Da cui:
X = 2,0 · 0,8 / 5,0 = 0,32 L
Pertanto il volume finale occupato dal gas è pari a 0,32 L.
Esercizio #2
Una certa quantità di elio, alla pressione di 3,0 atm, occupa il volume di 0,9 L. Mantenendo costante la temperatura, il volume del gas viene portato a 2,25 L. Si determini la nuova pressione del gas.
Svolgimento dell'esercizio
Applichiamo la legge di Boyle:
P1 · V1 = P2 · V2
in cui:
P1 = 3,0 atm
V1 = 0,9 L
P2 = ?
V2 = 2,25
Sostituendo in modo opportuno i dati in nostro possesso, risulta che:
3,0 · 0,9 = X · 2,25
da cui:
X = 3,0 · 0,9 / 2,25 = 1,2 atm
Pertanto la nuova pressione del gas è pari a 1,2 atm.
Esercizi sulla legge di Boyle
Li trovi al seguente link: esercizi legge di Boyle.
Link correlati:
Esercizio svolto sull'equazione di stato dei gas perfetti
Esercizio su una trasformazione isoterma di un gas
Qual è l'unità di misura dei gas? Che cosa rappresenta lo Smc?
Studia con noi