Ibridazione orbitalica
Ibridazione orbitalica: definizione e spiegazione
Consideriamo l'atomo di carbonio: la configurazione elettronica del carbonio è 1s2 2s2 2p2.
Come si può notare, il carbonio ha solo due orbitali 2p semipieni e, pertanto, dovrebbe dare origine solamente a due legami covalenti.
In realtà il carbonio, come nel metano CH4, è prevalentemente tetravalente, cioè in grado di formare 4 legami con altri atomi.
Si suppone la promozione di un elettrone dall'orbitale 2s all'orbitale 2p vuoto.
Tale atomo di carbonio eccitato ha ora quattro orbitali semipieni, e potrebbe formare quattro legami:
Tuttavia, siccome l'orbitale atomico 2s sferico ha energia inferiore e forma diversa da quella dei tre orbitali 2px, 2py, 2pz, dovremmo aspettarci tre legami uguali ed uno diverso.
Tutto ciò è in contrasto con i fatti sperimentali che accertano la presenza nel metano (CH4) di 4 legami covalenti identici.
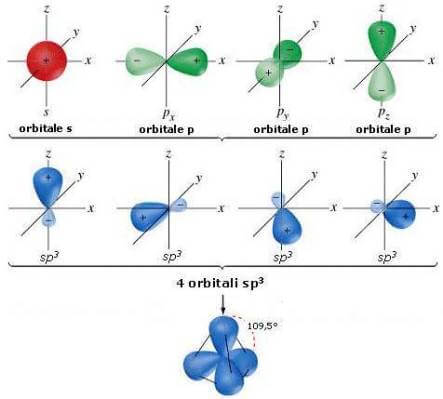
Ibridazione sp3 - singolo legame -
La teoria suggerisce il "mescolamento" dell'orbitale 2s con i tre orbitali 2p. Tale mescolamento è matematico, delle funzioni d'onda dell'orbitale, e quindi non è un reale fenomeno fisico.
Come risultato si ottengono 4 nuovi orbitali identici tra loro, di forma, energia e disposizione nello spazio del tutto diverse da quelle originarie. Questa operazione matematica prende il nome di ibridazione.
I nuovi 4 orbitali ibridi, chiamati sp3, hanno per ¼ le caratteristiche dell'orbitale s di partenza e per ¾ le caratteristiche degli orbitali 2p. Il 3 esponente di p indica il numero di orbitali p che partecipano alla formazione dell'ibrido.
I 4 orbitali ibridi sp3 sono tra loro identici e hanno la seguente forma:

Il lobo di dimensione maggiore è quello che viene utilizzato nei legami. Talvolta, per questioni di praticità, non si rappresenta il lobo di dimensione minore.
I quattro orbitali ibridi sp3 puntano verso i vertici di un tetraedro, disponendosi a 109,5° l'uno dall'altro:
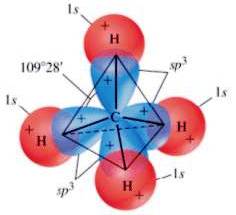
Nella formazione della molecola del metano, si ha una sovrapposizione tra i 4 orbitali ibridi sp3 e 4 orbitali 1s appartenenti a 4 atomi di idrogeno diversi:
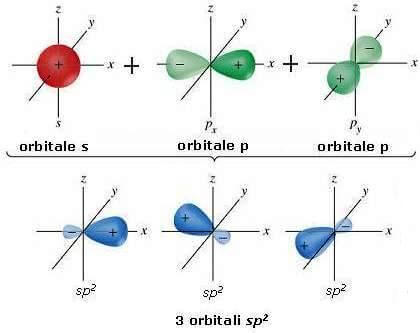
Ibridazione sp2 - doppio legame -
Oltre all'ibridazione sp3 esistono anche altre ibridazioni. Dal mescolamento di un orbitale s con due orbitali di tipo p si ottengono 3 orbitali ibridi detti orbitali sp2 che si dispongono su di un piano formando angoli di 120° l'uno dall'altro (geometria trigonale planare).
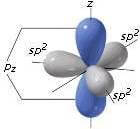
L'orbitale p non coinvolto nell'ibridazione si dispone perpendicolarmente al piano formato dai tre orbitali ibridi sp2.
Presentano ibridazione sp2 gli atomi di carbonio uniti da un legame covalente doppio (>C=C<), come ad esempio nella molecola dell'etene (o etilene) H2C=CH2.
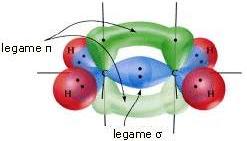
Il doppio legame C=C si realizza in seguito alla sovrapposizione frontale tra due orbitali ibridi sp2 (con formazione del legame σ) e alla sovrapposizione laterale tra i due orbitali p non coinvolti nell'ibridazione (con formazione del legame π).
In altre parole, il legame σ è dovuto alla sovrapposizione frontale dei due orbitali ibridi sp2 (ciascuno dei quali proviene da un atomo di carbonio) mentre il legame π è dovuto alla sovrapposizione laterale dei due orbitali p non coinvolti nell'ibridazione (ciascuno dei quali proviene da un atomo di carbonio).
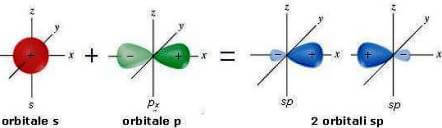
Ibridazione sp - triplo legame -
La combinazione di un orbitale di tipo s e uno di tipo p dà origine a 2 orbitali ibridi sp. Ogni orbitale ibrido sp ha il 50% di carattere s e il 50% di carattere p.
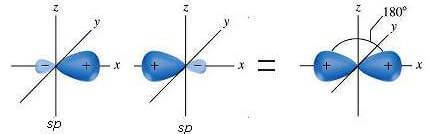
I due orbitali ibridi sp (nei quali per questioni di praticità, si omette di rappresentare il lobo di dimensione minore) si dispongono a 180° l'uno rispetto all'altro (geometria lineare).
Gli orbitali p non coinvolti nell'ibridazione sono disposti perpendicolarmente tra loro e sono perpendicolari ai due orbitali ibridi sp:
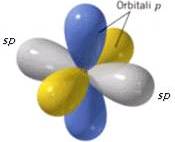
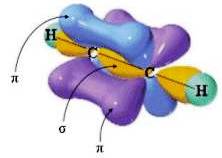
Presentano ibridazione sp gli atomi di carbonio uniti da un legame covalente triplo (-C≡C-), come ad esempio nella molecola dell'etino HC≡CH.
Il triplo legame -C≡C- si realizza in seguito alla sovrapposizione frontale tra due orbitali ibridi sp (con formazione del legame σ) e alla sovrapposizione laterale tra le due coppie di orbitali p non coinvolti nell'ibridazione (con formazione di due legami π).
In altre parole, il legame σ è dovuto alla sovrapposizione frontale dei due orbitali ibridi sp (ciascuno dei quali proviene da un atomo di carbonio); i due legami π sono dovuti alla sovrapposizione laterale tra le due coppie di orbitali p non coinvolti nell'ibridazione (ciascuna coppia di orbitali p, perpendicolari tra loro, proviene da un atomo di carbonio).
Link correlati:
Ibridazione dell'atomo di azoto
Studia con noi