Affinità elettronica
Affinità elettronica: definizione e spiegazione
Alcuni atomi tendono ad acquistare spontaneamente un elettrone formando ioni negativi (anioni) più stabili (e quindi con contenuto energetico minore) dell'atomo neutro da cui provengono.
Ad esempio, l'atomo di fluoro F con struttura elettronica esterna 2s2 2p5 tende ad acquistare spontaneamente un elettrone formando lo ione fluoruro F- con struttura elettronica esterna ad ottetto completo (2s2 2p6). Nel passaggio F → F− vengono liberati 328 KJ/mol. L'energia liberata (chiamata affinità elettronica) è tanto più alta quanto maggiore è la tendenza dell'atomo ad acquistare l'elettrone.
Se nell'acquisto di un elettrone da parte dell'atomo F si sviluppano 328 KJ/mol (F + e− → F− + 328 KJ/mol) ciò significa che occorre spendere 328 kJ per togliere l'elettrone agli anioni F− e riformare una mole di atomi F neutri; si può pertanto considerare il valore della affinità per l'elettrone come corrispondente al valore cambiato di segno dell'energia di ionizzazione dell'anione.
Definizione di affinità elettronica
L'affinità elettronica viene definita come l'energia, espressa in KJ/mol (o Kcal/mol), liberata da una mole di atomi neutri allo stato gassoso quando si trasforma in una mole di anioni monovalenti.

in cui A.E. è affinità elettronica. L'elettrone acquistato dall'atomo neutro, conferisce una carica negativa all'atomo, che diviene così uno ione negativo o anione.
Le dimensioni degli anioni (Atomo−) sono maggiori di quelle dei rispettivi atomi neutri (Atomo) vista la presenza di un elettrone in eccesso la cui carica non è adeguatamente bilanciata dalla carica del nucleo.
I valori numerici dell'affinità elettronica sono minori di quelli dell'energia di ionizzazione e sono soltanto le specie atomiche del settimo gruppo del sistema periodico che presentano apprezzabile tendenza ad acquistare spontaneamente elettroni: infatti esse hanno struttura elettronica esterna s2p5 e con l'acquisto di un elettrone assumono lo stato di ottetto s2p6 assai più stabile.
È possibile anche forzare elettroni a far parte della struttura di un atomo; in tal caso lo ione negativo ottenuto è meno stabile dell'atomo di origine (perché ha un contenuto di energia maggiore), ed il processo non è spontaneo.
Ad esempio l'ossigeno atomico (1s2 2s2 2p4) acquista spontaneamente un primo elettrone per dare l'anione l'anione O− (O + e- → O- + 141 kJ/mol): questo (1s2 2s2 2p5) dovrebbe tendere ad acquistare un secondo elettrone per formare l'anione O2− (1s2 2s2 2p6) con struttura elettronica esterna di ottetto; però lo ione O− negativo respinge l'elettrone, e per ottenere da esso l'anione O2− occorre spendere energia (circa 840 KJ/mol); l'anione O2− è pertanto poco stabile.
Come è possibile notare nella immagine seguente, l'affinità elettronica può quindi assumere valori sia negativi che positivi:
- negativi se il processo è spontaneo, cioè avviene con cessione di energia all'esterno (A + e− → A− + A.E.);
- positivi se il fenomeno, non spontaneo, avviene con apporto di energia dall'esterno (A + e− + E.A. → A−)
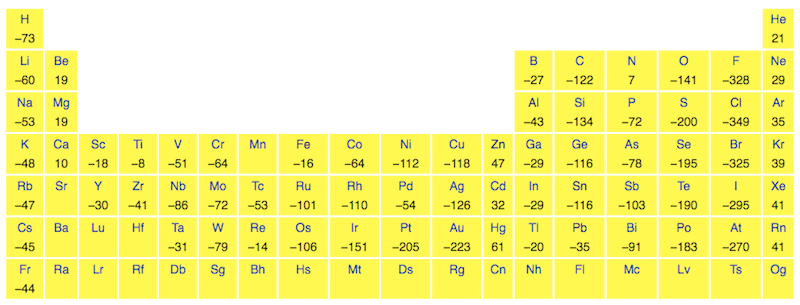
Gli elementi del settimo gruppo sono quelli che hanno i valori di affinità elettronica più alta e quindi la maggiore tendenza ad acquistare un elettrone. I valori positivi indicano energia acquistata dall'esterno (con formazione quindi di anioni instabili), e i valori negativi energia ceduta all'esterno (con formazione di anioni stabili).
Andamento dell'affinità elettronica nella tavola periodica
L'affinità elettronica è associabile alle dimensioni dell'atomo: è tanto maggiore quanto più piccolo è il volume atomico. Infatti più piccolo è un atomo, tanto più vicino al nucleo si collocherà l'elettrone acquistato, liberando maggiori quantità di energia.
Pertanto: l'affinità elettronica aumenta dal basso verso l'alto in un gruppo e da sinistra a destra in un periodo.
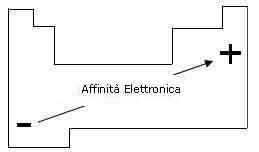
Andamento dell'affinità elettronica: all'aumentare dell'affinità elettronica diminuisce il carattere metallico.
Affinità elettronica e convenzione sui segni
La definizione fino ad ora seguita vuole un valore dell'affinità elettronica tanto più negativo quanto maggiore è l'affinità elettronica; non tutti gli autori sono concordi su tale definizione.
Secondo alcuni autori, infatti, l'affinità elettronica deve avere un segno contrario alla convenzione che vuole segno - all'energia liberata durante una reazione chimica; solo in questo caso infatti il valore positivo corrisponde semanticamente al nome della proprietà (affinità per gli elettroni).
Per tale motivo talvolta si preferisce definire l'affinità elettronica come l'energia che bisogna fornire (e quindi con segno +) ad uno ione negativo (anione) per strappargli un elettrone:
![]()
Link correlati:
Che cos'è l'effetto termoionico?
Studia con noi