Percentuale di ionizzazione
Calcolo della percentuale di ionizzazione di un acido debole monoprotico conoscendo molarità e pH
Si calcoli la percentuale di ionizzazione di un acido debole monoprotico sapendo che una sua soluzione 0,12 M ha un pH di 2,56.
Svolgimento dell'esercizio
L'esercizio propone il calcolo della percentuale di ionizzazione di un acido debole monoprotico sapendo che una sua soluzione 0,12 M ha un pH di 2,56.
La percentuale di ionizzazione di un acido debole indica la percentuale di moli ionizzate dell'acido debole. Infatti per definizione un acido debole è un acido parzialmente ionizzato.
Considerando un generico acido debole HA la ionizzazione può essere descritta dalla seguente equazione chimica:
HA ⇄ H+ + A−
Per un acido debole monoprotico la percentuale di ionizzazione può essere calcolata mediante la seguente formula:

in cui:
- [A−] è la concentrazione in mol/L dello ione A− in soluzione;
- Ca è la concentrazione iniziale in mol/L dell'acido.
Conosciamo il pH della soluzione; dal pH è possibile determinare la concentrazione dello ione H+ mediante la seguente formula:
[H+] = 10-pH
Da cui:
[H+] = 10-2,56 = 2,75 · 10-3 mol/L
Ma la concentrazione dello ione H+ corrisponde alla concentrazione dello ione A−, infatti per ogni mole di HA che si ionizza si forma uno mole di ioni H+ e una mole di ioni A− e quindi la loro concentrazione è la stessa. Pertanto:
[A−] = 2,75 · 10-3 mol/L
A questo punto non ci rimane altro che applicare la formula vista in precedenza:

in cui:
- [A−] = 2,75 · 10-3 mol/L
- Ca = 0,12 mol/L
Sostituendo si ha che:
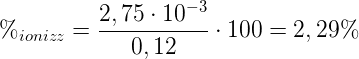
Pertanto la percentuale di ionizzazione dell'acido HA è pari al 2,29%. Ciò significa che 2,29 mol di acido su 100 mol iniziali si sono ionizzate.
Studia con noi