Relazione sulla titolazione acido-base
Relazione di laboratorio: titolazione acido-base
Introduzione
La titolazione è un tipo di analisi chimica che viene utilizzata per determinare la concentrazione incognita di un acido o di una base in una soluzione (analita) facendola reagire con una soluzione a concentrazione nota rispettivamente di una base o un acido (soluzione titolante).
Scopo dell'esperienza
Determinare la concentrazione incognita di una soluzione di acido cloridrico HCl per titolazione con una soluzione di idrossido di sodio NaOH a concentrazione nota.
Attrezzature
Sostegno con pinza porta-burette
Buretta da 50 mL, sensibilità 0,1 mL
Pipetta tarata da 25 mL
Propipetta
Beuta da 250 mL
Spruzzetta
Materiali e reagenti
Soluzione 0,100 M di NaOH (fiala normex)
Soluzione a concentrazione incognita di HCl*
Indicatore fenolftaleina
Procedimento
Avvinare la buretta per 2-3 volte utilizzando pochi mL della soluzione di NaOH.
Chiudere il rubinetto della buretta e riempirla completamente con la soluzione di NaOH.
Eliminare le bolle d'aria presenti nella parte inferiore del rubinetto della buretta aprendo rapidamente il rubinetto per circa 1-2 secondi.
Fissare la buretta alla pinza porta-buretta.
Portare il menisco sullo zero della scala graduata spillando o rabboccando il liquido all'interno della buretta. La lettura deve essere fatta in corrispondenza della parte inferiore del menisco evitando errori di parallasse e posizionando lo sguardo all'altezza del menisco.
Con una pipetta tarata da 25 mL precedentemente avvinata si preleva la soluzione di HCl e la si sgocciola lentamente all'interno di una beuta da 250 mL (in alternativa la soluzione di HCl può essere prelevata tramite una buretta).
All'interno della beuta aggiungere 2-3 gocce di indicatore fenolftaleina e circa 20 mL di acqua distillata.
Muovendo la beuta in senso rotatorio, aggiungere goccia a goccia la soluzione di NaOH presente nella buretta alla soluzione di HCl presente nella beuta.
Avviene la seguente reazione:
HCl(aq) + NaOH(aq) → NaCl(aq) + H2O(l)
In prossimità del punto finale della titolazione, nel punto di contatto tra la goccia di NaOH e la soluzione di HCl si forma una colorazione rosa sempre più persistente.
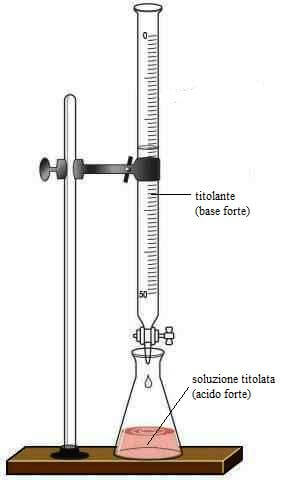
Titolazione di acidi forti con basi forti
Quando la soluzione assume una colorazione rosa persistente, interrompere immediatamente l'erogazione della soluzione di NaOH chiudendo il rubinetto della buretta.
Annotare il volume di NaOH consumato nella titolazione.
Elaborazione dati
Al punto di equivalenza vale la seguente relazione:
molacido = molbase
Ovvero:
Ma · Va = Mb · Vb
in cui:
Ma = molarità acido (valore incognito)
Va = volume acido prelevato = 25 mL
Mb = molarità NaOH = 0,100 mol/L
Vb = volume NaOH consumato (lettura buretta)
Da cui si calcola la molarità incognita dell'acido:
Ma = (Mb · Vb) / Va
* La concentrazione della soluzione di HCl deve essere simile a quella di NaOH
Studia con noi