Influenza della concentrazione dei reagenti sulla velocità di reazione
Relazione di laboatorio: influenza della concentrazione dei reagenti sulla velocità di reazione
Introduzione
La velocità di una reazione chimica è proporzionale alla frequenza delle collisioni tra le particelle dei reagenti ed è proporzionale quindi alla concentrazione dei reagenti.
Il permanganato di potassio (KMnO4) è una sostanza violetta che sciolta in acqua forma una soluzione intensamente colorata.
Reagendo con l'acido ossalico (H2C2O4) in ambiente acido per aggiunta di H2SO4, una soluzione di permanganato di potassio tende a decolorarsi.
La totale decolorazione della soluzione indica quindi la scomparsa del permanganato e il completamento della reazione.
![]()
Scopo dell'esperienza
Mantenendo costante la temperatura, si vuole verificare l'influenza della concentrazione dei reagenti sulla velocità della reazione tra permanganato di potassio e acido ossalico.
Attrezzature
2 cilindri graduati da 50 mL
8 becher da 100 mL
Cronometro
Materiali e reagenti
Soluzione di KMnO4 0,02 M
Soluzione di H2C2O4 0,1 M
H2SO4 concentrato
Procedimento
Preparare una prima serie di quattro becher ciascuno dei quali contenenti 10 mL della soluzione di KMnO4 0,02 M.
Preparare una seconda serie di quattro becher ciascuno dei quali contenenti 10 mL della soluzione di H2C2O4 0,1 M, 2 mL di H2SO4 concentrato e rispettivamente 0, 20, 40, 60 mL di acqua distillata (vedere tabella).
Versare la soluzione del primo becher della seconda serie (soluzione di acido ossalico) in uno dei becher contenenti la soluzione di KMnO4.
Azionare il cronometro.
Annotare il tempo impiegato dalla reazione per raggiungere la totale decolorazione della soluzione (completamento della reazione).
Versare la soluzione del secondo becher della seconda serie in uno dei becher contenenti la soluzione di KMnO4.
Azionare il cronometro.
Annotare il tempo impiegato dalla reazione per raggiungere la totale decolorazione della soluzione (completamento della reazione).
Procedere in modo identico con i restanti becher.
Elaborazione ed analisi dei dati
Completare la seguente tabella.
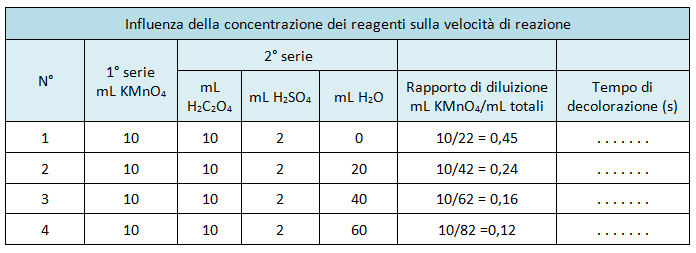
Su un foglio di carta millimetrata tracciare un sistema di assi cartesiani e riportare sull'asse delle ascisse i valori dei rapporti di diluizione e sull'asse delle ordinate i valori dei tempi di decolorazione espressi in secondi.
Conclusioni
Si dovrebbe osservare che, in accordo con la teoria, il tempo di decolorazione della soluzione aumenta all'aumentare del rapporto di diluizione.
Studia con noi