Trasformazioni esotermiche ed endotermiche
Relazione di laboratorio: trasformazioni esotermiche ed endotermiche
Introduzione
Molte trasformazioni sia fisiche che chimiche avvengono con scambio di calore con l'ambiente circostante.
Se la trasformazione avviene con emissione di calore è detta esotermico; se la trasformazione avviene con assorbimento di calore è detta endotermica.
Scopo dell'esperienza
Verificare il comportamento termico (esotermico / endotermico) di alcuni processi fisici di solubilizzazione.
Attrezzature
Termometro con intervallo 10-100°C
Alcuni becher da 250 mL
Bacchetta di vetro
Bilancia tecnica
Materiali e reagenti
Idrossido di sodio solido (in grani)
Cloruro di sodio NaCl
Ossido di calcio CaO
Bicarbonato di sodio NaHCO3
Acqua distillata
Procedimento
Pesare alla bilancia tecnica le quantità di sostanza di seguito indicate:
Idrossido di sodio solido = 4 g
Nitrato di ammonio = 8 g
Cloruro di ammonio = 6 g
Nitrito di sodio = 6 g
Cloruro di sodio = 6 g
Ossido di calcio = 6 g
Bicarbonato di sodio = 10 g
Porre in un becher 100 mL di acqua distillata.
Agitare con un termometro e annotare la temperatura iniziale (ti).
Aggiungere all'acqua distillata una delle sostanze solide precedentemente pesate ed agitare con una bacchetta di vetro sino a completa solubilizzazione del solido.
Leggere ed annotare la temperatura finale della soluzione (tf).
Ripetere il procedimento con tutte le sostanze pesate.
Elaborazione dati
Compilare la seguente tabella indicando, per ogni prova effettuata, la temperatura iniziale, la temperatura finale e la differenza di temperatura Δt = tf - ti.
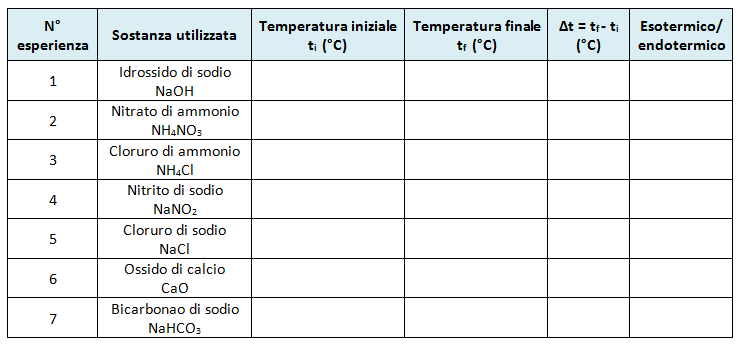
Valori positivi di Δt indicano una trasformazione esotermica, valori negativi di Δt indicano una trasformazione endotermica.
Studia con noi