Sali acidi
Sali acidi: nomenclatura tradizionale e IUPAC
I sali acidi sono sali che nella loro formula chimica contengono uno o più atomi di idrogeno.
Ne sono esempi: NaHCO3, KH2PO4, LiH2PO3.
Essi si ottengono da una parziale sostituzione degli atomi di idrogeno dell'acido poliprotico da cui il sale deriva con ioni metallici.
Per esempio, consideriamo l'acido solfidrico H2S.
Per totale sostituzione degli atomi di idrogeno con ioni metallici (esempio Na+) otteniamo il solfuro di sodio Na2S (sale neutro).
Se anziché entrambi gli idrogeni ne sostituiamo soltanto uno dei due, otteniamo il sale NaHS che è appunto un sale acido.
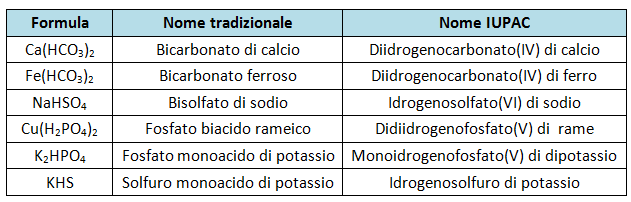
Vediamo alcuni esempi di sali acidi e le corrispondenti nomenclature.
pH di sali acidi
Per il calcolo del pH di sali acidi, si deve tenere conto che l'anione che deriva dall'acido è un anfotero e quindi può comportarsi sia da acido di Bronsted-Lowry che da base.
Prendendo come esempio il bicarbonato di sodio NaHCO3, si ha che lo ione HCO3− può dare i seguenti due equilibri:
HCO3− + H2O ⇄ H2CO3 + OH−
HCO3− + H2O ⇄ CO32− + H3O+
In questi casi il pH risultante dipende da quale dei due equilibri è più spostato a destra.
Se prevale il primo la soluzione risulterà basica, se prevale il secondo, la soluzione sarà acida.
Il calcolo del pH però è in questi casi un'operazione molto semplice e si effettua con la seguente formula:
![]()
nella quale Ka1 e Ka2 sono i valori delle due costanti acide di dissociazione dell'acido carbonico.
Studia con noi