Reazioni del Secondo Ordine
Equazione cinetica delle reazioni del secondo ordine
La legge cinetica delle reazioni del secondo ordine è data da una delle seguenti relazioni matematiche:
![]()
![]()
da cui risulta che la velocità di reazione è direttamente proporzionale o al prodotto delle concentrazioni di due reagenti o al quadrato della concentrazione di uno solo dei reagenti.
In esse la costante cinetica k viene misurata in: L · mol-1 · s-1.
Legge cinetica del tipo v = k · [A] · [B]
L'equazione di velocità v = k · [A] · [B] può essere scritta anche in forma integrata:
![]()
nella quale:
- [A]0 e [B]0 indicano le concentrazioni iniziali dei reagenti A e B
- [A]t e [B]t indicano le concentrazioni dei reagenti A e B al tempo t
- t indica il tempo di reazione
- k indica la costante cinetica
Riportando in un sistema di assi cartesiani il valore ln ([A]/[B]) in funzione del tempo t, si ottiene una retta con pendenza k · ([A]0 - [B]0) :
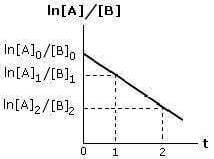
La costante di velocità specifica k può essere determinata conoscendo i valori della concentrazione del reagente A in due momenti diversi (t2 e t1).
Dalla relazione:
![]()
si ottiene che k vale:
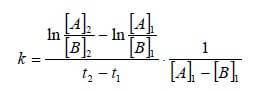
Legge cinetica del tipo v = k · [A]2
L'equazione di velocità v = k · [A]2 può essere scritta anche in forma integrata. Quest'ultima mette in relazione la concentrazione del reagente A con il tempo di reazione t:
![]()
Riportando in un sistema di assi cartesiani il valore 1/[A] in funzione del tempo t, si ottiene una retta con pendenza k:
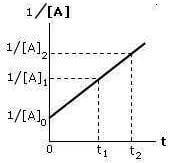
La costante di velocità specifica k può essere determinata conoscendo i valori della concentrazione del reagente A in due momenti diversi (t2 e t1).
Dalla relazione:
![]()
si ottiene che il valore della costante k è:
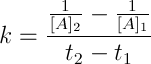
Il tempo di dimezzamento per reazioni del secondo ordine che seguono una cinetica del tipo v = k · [A]2 dipende dalla concentrazione iniziale del reagente A. Poniamo infatti:
[A]t = ½ [A]o
Sostituendo questo dato nella:
![]()
si ha che:
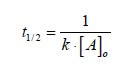
Esercizi di cinetica chimica
Li trovi al seguente link: esercizi di cinetica chimica.
Altri esercizi:
Esercizio svolto su una reazione del secondo ordine
Link correlati:
chimica fisica Atkins (libro)
Studia con noi