Ossidi e anidridi
Ossidi e anidridi: nomenclatura tradizionale e IUPAC
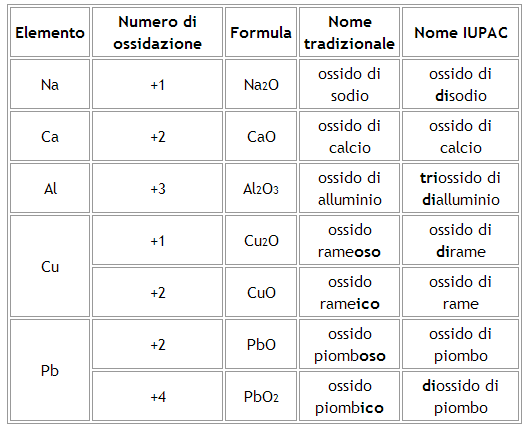
Nomenclatura di ossidi (ossidi basici)
Un ossido basico è un composto binario costituito da ossigeno (con numero di ossidazione -2) e da un metallo.
La reazione di formazione di un ossido può essere pertanto così rappresentata:
Metallo + Ossigeno → Ossido
Applicando la "Regola dell'incrocio" risulta che la formula generale di un ossido è Me2On in cui:
Me = simbolo chimico del metallo;
n = numero di ossidazione del metallo.
La nomenclatura tradizionale prevede:
Se il metallo ha un solo numero di ossidazione il composto si chiamerà “Ossido di” seguito dal nome del metallo.
Se il metallo presenta due numeri di ossidazione forma con l'ossigeno due ossidi diversi. Nell'ossido a numero di ossidazione maggiore il metallo prende il suffisso -ico, in quello a numero di ossidazione minore prende il suffisso -oso.
La nomenclatura IUPAC prevede:
la denominazione “ossido di” seguita dal nome del metallo, utilizzando anche opportuni prefissi che precedono sia il termine “ossido” sia il nome del metallo. I prefissi dei nomi IUPAC corrispondono ai numeri che compaiono nelle formule (2 = di; 3 = tri; 4 = tetra; 5 = penta; 6 = esa; etc.).
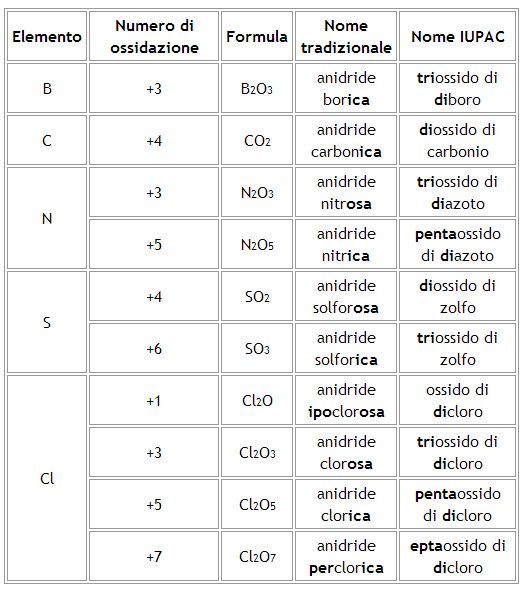
Nomenclatura di anidridi (ossidi acidi)
Una ossido acido è un composto binario costituito da ossigeno (con numero di ossidazione -2) e da un non-metallo.
Non metallo + O2 → ossido acido
Applicando la "Regola dell'incrocio" risulta che la formula generale di un ossido acido è nMe2On in cui:
nMe = simbolo chimico del non-metallo;
n = numero di ossidazione del non-metallo.
La nomenclatura tradizionale prevede:
Se il non metallo presenta un unico numero di ossidazione il composto si chiamerà “Anidride” seguito dal nome del non metallo con desinenza -ica.
Se il non metallo presenta due numeri di ossidazione può formare con l'ossigeno due anidridi diverse.
Nel composto a numero di ossidazione maggiore il non metallo prende il suffisso -ica, in quello a numero di ossidazione minore prende il suffisso -osa.
Se il non metallo presenta quattro numeri di ossidazione può formare con l'ossigeno quattro anidridi diverse.
Nel composto a numero di ossidazione maggiore il non metallo prende il prefisso per- e il suffisso –ica
Nel composto a numero di ossidazione minore il non-metallo prende il prefisso ipo- e il suffisso -osa.
Nei composti a numero di ossidazione intermedi, per il non-metallo si avranno il suffisso –ica (per il numero di ossidazione più elevato dei due) ed -osa (per il numero di ossidazione meno elevato dei due).
l'unico non-metallo ad avere quattro numeri di ossidazione è il cloro.
La nomenclatura IUPAC prevede:
la denominazione “ossido di” seguita dal nome del non metallo, con l'utilizzo di opportuni prefissi che precedono sia il termine “ossido” sia il nome del non metallo. I prefissi dei nomi IUPAC corrispondono ai numeri che compaiono nelle formule (2 = di; 3 = tri; 4 = tetra; 5 = penta; 6 = esa; etc.).
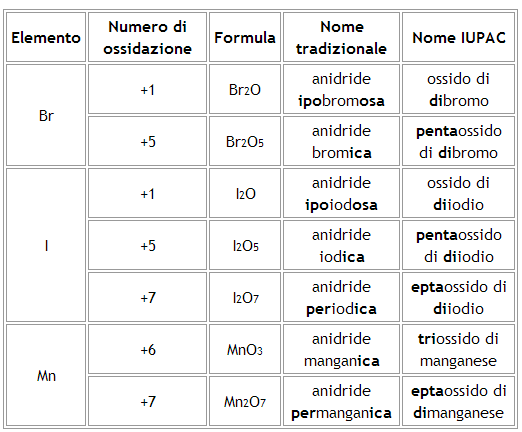
Analoga nomenclatura a quella del cloro vale per bromo, iodio e manganese, anche se tali elementi non hanno quattro numeri di ossidazione.
NOTA - Si conoscono anche i seguenti composti binari ossigenati:
N2O (protossido di azoto)
NO (ossido di azoto)
CO (ossido di carbonio)
MnO2 (biossido di manganese)
i quali però, non essendo basici né acidi, non possono essere attribuiti ad alcuna delle due specie sopra descritte.
Per l'azoto, esiste anche il composto NO2 (in cui N ha numero di ossidazione +4); tale composto viene chiamato comunemente biossido di azoto, talvolta ipoazotide, o anche anidride nitrosa-nitrica, perché, se messo in acqua, si comporta come se fosse N2O3 (anidride nitrosa) e, insieme, come se fosse N2O5 (anidride nitrica), infatti si può scrivere:
4NO2 → N2O3 + N2O5
Esercizi sulla nomenclatura
Se ti interessa svolgere esercizi sulla nomenclatura vai al seguente link: esercizi sulla nomenclatura chimica.
Quiz sulla nomenclatura chimica
Li trovi qui: quiz sulla nomenclatura chimica.
Link correlati:
Esercizi online e gratuiti sulla nomenclatura degli ossidi
Studia con noi