Orbitale di Tipo d
Caratteristiche dell'orbitale d
Per ogni valore del numero quantico principale n > 2 vi sono 5 orbitali di tipo d che hanno numero quantico secondario l = 2.
Per l = 2, il numero quantico magnetico m assume cinque possibili valori (-2, -1, 0, +1, +2) che indicano cinque diverse orientazioni nello spazio dell'orbitale.
Il sottolivello d è dunque formato da cinque orbitali indicati con le sigle dxy, dxz, dyz, dx2-y2, dz2 rappresentati nella seguente figura:
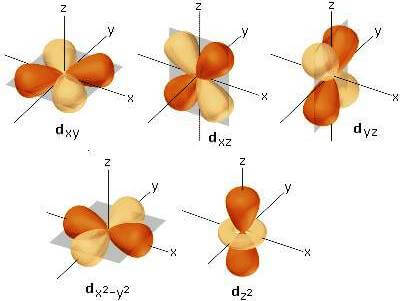
Rappresentazione dei cinque orbitali di tipo d.
Come è possibile notare, quattro dei cinque orbitali di tipo d sono tetralobati con la funzione d'onda Ψ che assume segno alternativamente opposto. Il quinto orbitale di tipo d, invece, è un orbitale bilobato che presenta una regione anulare che circonda il nucleo ad alta densità elettronica in cui la funzione d'onda Ψ assume segno opposto.
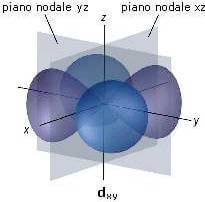
Ciascuno dei quattro orbitali di tipo d tetralobali presentano due piani nodali. Ad esempio, l'orbitale dxy presenta due piani nodali (piano nodale xz e paino nodale yz) perpendicolari tra loro che si intersecano, come rappresentato nella figura seguente, sull'asse delle z:
I cinque orbitali di tipo d hanno uguale energia e pertanto si dice che il sottolivello di tipo d è formato da cinque orbitali degeneri.
Il sottolivello d è saturo con 10 elettroni. Nel caso in cui l'orbitale è parzialmente occupato da cinque elettroni, in accordo con la regola di Hund esso viene rappresentato nel seguente modo:
![]()
In accordo con il principio di esclusione di Pauli, il successivo elettrone viene collocato nel seguente modo:
![]()
Link correlati:
Qual è la differenza tra orbita e orbitale?
Che cos'è la meccanica razionale?
Che cosa sono le orbite ellittiche?
Quanti elettroni possono essere contenuti al massimo in un orbitale
Studia con noi