Come si determina la massa di un elemento con la media ponderata
Determinazione della massa di un elemento considerando la percentuale e la massa di ciascun isotopo
La maggior parte degli elementi che si trovano in natura sono costituiti da una miscela di isotopi e tale miscela presenta, salvo piccoli scarti dovuti all'origine radioattiva di alcuni di essi, composizione costante. Il cloro ad esempio è sempre costituito dal 75,8% di 35Cl e dal 24,2 di 37Cl.
La massa di un isotopo (ad esempio del 35Cl) coincide praticamente con la somma delle masse dei protoni e dei neutroni.
Infatti ciascuna di queste particelle ha una massa di circa 1 uma (unità di massa atomica) e la massa degli elettroni è trascurabile. In base a questo ragionamento la massa del 35Cl è circa 35 uma (34,969 u).
Stesso discorso vale per l'altro isotopo del cloro, il 37Cl. La massa di questo isotopo è circa 37 uma (36,966 u).
Se consultiamo la tavola periodica risulta che la massa atomica del cloro è 35,45 uma. Come si giustifica questo valore?
In realtà il valore riportato per ogni elemento chimico nella tavola periodica non si riferisce alla massa atomica di un particolare isotopo, ma rappresenta la media ponderata delle masse atomiche di ciascun isotopo presente nella miscela naturale, media che tiene conto dell'abbondanza di ogni isotopo.
Consideriamo l'abbondanza in natura di ciascun isotopo del cloro (abbondanza isotopica) e le rispettive masse
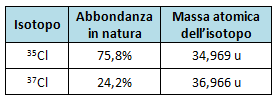
possiamo determinare la media ponderata delle masse dei due isotopi nel seguente modo:
![]()
Tale valore corrisponde alla massa atomica del cloro che dunque è una media ponderata delle masse degli isotopi di quell'elemento.
Elemento costituito da un unico nuclide
Nel caso in cui l'elemento non è costituito da una miscela di isotopi (è il caso del sodio che esiste unicamente come 23Na) allora in quel caso la massa atomica dell'elemento corrisponde alla massa dell'unico nuclide esistente in natura.
Nel caso del sodio la massa dell'elemento corrisponde quindi alla massa del 23Na.
Esercizi sul calcolo delle masse atomiche
Se ti interessano esercizi di questo tipo, segui il seguente link: esercizi sull'atomo.
Link correlati:
Come convertire gli uma in grammi
Tool online e gratuito per il calcolo della massa molecolare
Come si calcola la massa atomica assoluta di un atomo
Studia con noi