Legge di Proust
Enunciato e spiegazione della legge di Proust
Nel 1799 il chimico francese J.L. Proust, rifugiatosi in Spagna durante la Rivoluzione Francese, notò che la composizione della pirite, un minerale molto abbondante in quel paese, era sempre la stessa indipendentemente dal luogo di provenienza.
In particolare, trovò che la pirite conteneva ferro e zolfo e che questi due elementi erano presenti secondo un rapporto fisso e costante: per ogni grammo di ferro erano sempre presenti 0,57 grammi di zolfo. Tale composizione era rispettata anche dalla pirite da lui ottenuta in laboratorio.
Proust estese i suoi studi anche ad altri minerali e constatò che tale regolarità di comportamento nei rapporti di combinazione era comune anche anche agli altri minerali.
Tali considerazioni lo portarono a formulare la legge delle proporzioni definite (nota anche come legge di Proust) che afferma:
in un composto chimico gli elementi che lo costituiscono sono sempre presenti in rapporti in massa costanti e definiti.
Spiegazione della legge di Proust
Se si vuole preparare in laboratorio del solfuro ferroso (pirite), occorre fare reagire ferro e zolfo nel rapporto di 1 g di ferro per 0,57 g di zolfo. In accordo con la legge di Lavoisier, si otterranno 1,57 g di solfuro ferroso.
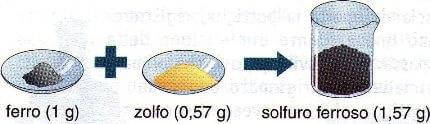
1 grammo di ferro reagisce con 0,57 grammi di zolfo.
Se vogliamo ottenere una quantità di solfuro ferroso dieci volte maggiore e cioè 15,7 g, bisogna sempre rispettare il rapporto di combinazione (1 : 0,57) tra ferro e zolfo e quindi bisogna mettere a reagire 10 g di ferro con 5,7 g di zolfo:
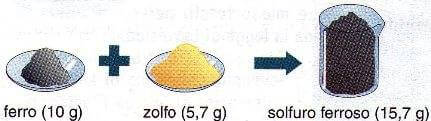
10 grammi di ferro reagiscono con 5,7 grammi di zolfo.
Se invece mettiamo a reagire 10 g di ferro con 8 g di zolfo, una quantità superiore a quella richiesta dal rapporto di combinazione (5,7 g), si otterrà sempre la stessa quantità di solfuro ferroso (15,7 g) ma parte dello zolfo (8 g - 5,7 g = 2,3 g) non reagisce per dare il solfuro ferroso e rimane inalterato alla fine della reazione:
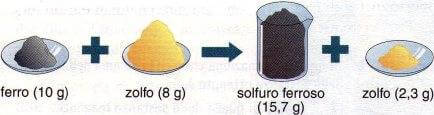
Se si fanno reagire 10 g di ferro con 8 grammi di zolfo, quest'ultimo, in eccesso, non reagirà completamente.
Allo stesso modo, per ottenere acqua, un composto formato da idrogeno e ossigeno, dobbiamo fare reagire questi due elementi nel rapporto di 1 g di idrogeno contro 8 g di ossigeno. Qualsiasi eccesso di uno dei due elementi nei confronti di tale rapporto, non reagisce per dare acqua e rimane come reagente in eccesso a fine reazione.
Qualche anno più tardi J. Dalton scoprì casi in cui due elementi possono reagire per dare due composti diversi e formulò la legge delle proporzioni multiple o legge di Dalton.
Esercizio #1
Nel cloruro di sodio (sale da cucina) il rapporto di combinazione tra sodio e cloro Na : Cl, è di 0,65 : 1. Calcola la massa in grammi di cloro che si combina con 20 grammi di sodio.
Svolgimento dell'esercizio
L'esercizio propone il calcolo della massa di cloro che reagisce con 20 grammi di sodio sapendo che sodio e cloro si combinano tra loro, per formare il cloruro di sodio, nel rapporto di 0,65 a 1.
Poiché dal rapporto di combinazione Na : Cl risulta che 0,65 g di sodio si combinano con 1 grammi di cloro, è possibile impostare la seguente proporzione diretta:
0,65 : 1,0 = 20 : X
Da cui possiamo ricavare X, ovvero la massa di cloro che si combina con 20 grammi di sodio:
X = 20 · 1 / 0,65 = 30,77 g
Pertanto la massa di cloro che si combina con 20 grammi di sodio è pari a 30,77 g.
Esercizio #2
Nell'acqua il rapporto di combinazione tra ossigeno e idrogeno O : H, è di 1 : 0,126. Calcola la massa in grammi di ossigeno che si combina con 8 grammi di idrogeno.
Svolgimento dell'esercizio
Poiché dal rapporto di combinazione O : H risulta che 1 g di ossigeno si combina con 0,126 grammi di idrogeno, è possibile impostare la seguente proporzione diretta:
1 : 0,126 = X : 8
Da cui possiamo ricavare X, ovvero la massa di ossigeno che si combina con 8 grammi di idrogeno; risolvendo la proporzione risulta che:
X = 8 · 1 / 0,126 = 63,49 g
Pertanto, la massa di ossigeno che si combina con 8 grammi di idrogeno è pari a 63,49 g.
Esercizi sulla legge di Proust
Li trovi al seguente link: esercizi sulla legge di Proust.
Link correlati:
Che cosa studia la meccanica dei fluidi?
Studia con noi