Equazione di Nernst
Il potenziale d'elettrodo e l'equazione di Nernst
L'equazione di Nernst permette di calcolare il potenziale di riduzione di una coppia redox in condizioni di concentrazione e di temperatura diverse da quelle standard.
Per una qualsiasi reazione redox:
![]()
Formula dell'equazione di Nernst
Applicando l'equazione di Nernst, il potenziale in condizioni di concentrazione non standard E, si può calcolare nel seguente modo:
![]()
in cui:
- E° = potenziale standard di riduzione
- R = costante dei gas che vale 8,314 J · mol-1 · K-1
- T = temperatura assoluta
- n = numero di elettroni scambiati
- F = costante di Faraday che vale 96485 Coulomb
- [Red] = concentrazione della specie ridotta
- [Ox] = concentrazione della specie ossidata
- n e m sono gli eventuali coefficienti stechiometrici della specie ridotta e della specie ossidata
Trasformando il logaritmo naturale in logaritmo decimale (ln = 2,302 log) e sostituendo nell'equazione precedente i valori di R, T, F che sono valori costanti (per T si considera la temperatura di 298 K), l'equazione di Nernst diventa:
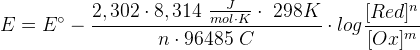
da cui:
![]()
È facile dimostrare che se [Red] = [Ox] = 1 M, si ha che E = E°.
Esercizio
Calcolare il potenziale di riduzione alla temperatura standard di un semielemento costituito da una bacchetta di rame immersa in una soluzione 0,001 M di ioni Cu2+.
La reazione di riduzione è la seguente:
Cu2+ + 2e− → Cu
per la quale vale:
E° = 0,345 V
Applicando l'equazione di Nernst è possibile determinare il potenziale di riduzione:
E = E° - (0,059/2) · log (1 / [Cu2+])
da cui:
E = 0,345 - (0,059/2) · log (1 / [0,001]) = 0,256 V
Link correlati:
Esercizi svolti sull'equazione di Nernst e il calcolo del potenziale di riduzione
Esercizi svolti e commentati sulle pile
Studia con noi