Equazione di Arrhenius
Velocità di reazione ed equazione di Arrhenius
Il valore della costante specifica di velocità può essere calcolato mediante l'equazione matematica del chimico svedese Svante Arrhenius:
![]()
dove:
k = costante specifica di velocità o costante cinetica
A = noto come "fattore di frequenza" è una costante caratteristica che dipende dalla natura dei reagenti
Ea = energia di attivazione della reazione
R = costante universale dei gas
L'equazione matematica mette in evidenza come la costante specifica di velocità (e quindi la velocità della reazione) cresca in modo esponenziale al crecere della temperatura assoluta e al diminuire dell'energia di attivazione.
In essa il termina A è chiamato fattore pre-esponenziale il cui valore dipende solo marginalmente dalla temperatura:
![]()
Esso rappresenta il valore che la costante specifica di velocità assumerebbe a temperatura infinita: infatti per T tendente all'infinito, il fattore e-Ea/RT tende a 1 e quindi k = A.
Il termine
![]()
dell'equazione di Arrhenius rappresenta invece la frazione di urti che, ad una certa temperatura T ha energia sufficiente a superare l'energia di attivazione.
Tale termine aumenta all'aumentare della temperatura T.
Equazione di Arrhenius e teoria degli urti
Dalla teoria degli urti sappiamo infatti che affinché si abbia una reazione chimica, le molecole dei reagenti devono urtarsi oltre che con una corretta orientazione, anche con una energia sufficientemente violenta tale da superare il valore dell'energia di attivazione.
La meccanica statistica dimostra che, ad una certa temperatura, non tutte le molecole possiedono sufficiente energia cinetica tale da superare il valore della energia di attivazione, ma le energie cinetiche si distribuiscono secondo una curva caratteristica detta maxwelliana:
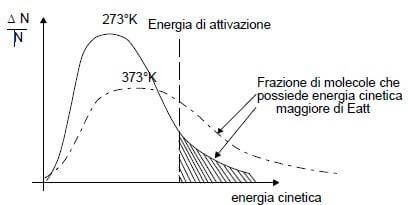
Dall'osservazione del grafico si intuisce che all'aumentare della temperatuta T aumenta la frazione di molecole che ha una energia cinetica superiore al valore dell'energia di attivazione.
Nell'equazione della costante specifica di velocità la temperatuta T interviene non soltanto nel termine esponenziale e-Ea/(RT) ma anche come T½ inglobata questa nel termine A.
Quindi, all'aumentare della temperatura, il valore della costante specifica di velocità k aumenta poiché aumentano entrambi i termini T½ ed e-Ea/(RT).
L'aumento del valore della costante specifica di velocità dovuto al primo fattore (T½) però, è tanto minore rispetto a quello dovuto al secondo fattore (e-Ea/(RT)), da essere, in prima approssimazione, trascurabile.
Studia con noi