Calorimetro
Come si misura il calore di reazione mediante il calorimetro
In questa lezione studieremo che cos'è, come è fatto, e da quali componenti è costituito un calorimetro; vedremo a cosa serve e perché è un dispositivo così importante in calorimetria. Infine, tramite un esempio numerico, vedremo come si procede alla taratura di un calorimetro allo scopo di determinare la sua capacità termica.
Che cos'è il calorimetro?
Il calorimetro è un dispositivo impiegato in calorimetria per determinare la quantità di calore svolta durante una reazione chimica.
Di esso ne esistono di diversi tipi: la bomba calorimetria, detta anche bomba di Mahler e il calorimetro a ghiaccio; vediamoli nel dettaglio.
Bomba calorimetrica o bomba di Mahler
Un importante calorimetro è la "bomba di Mahler" o "bomba calorimetrica" con cui si determina il calore di combustione di sostanze solide o liquide.
Essa consiste in un piccolo recipiente di acciaio a pareti robuste, ermeticamente chiuso, in cui è posta una piccola capsula di porcellana contenente la sostanza in esame; nel recipiente viene immesso ossigeno puro e la combustione viene innescata mediante una resistenza elettrica a contatto con la sostanza.
Facendo passare corrente elettrica nella spiralina della resistenza elettrica, questa si arroventa e brucia, provocando la rapida combustione del composto.
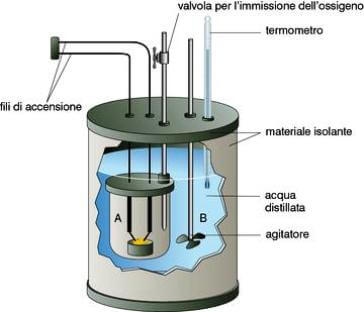
Bomba calorimetrica o bomba di Mahler.
Il calore della reazione viene assorbito da una quantità nota di acqua, in cui è immersa la "bomba".
Nota, mediante taratura, la capacità termica C del calorimetro e tenendo conto che il calore specifico dell'acqua è uguale a 4,184 J·g-1·°C-1, possiamo risalire alla quantità di calore messa in gioco nella reazione dall'espressione:
![]()
in cui:
- m = massa in grammi dell'acqua presente all'interno del calorimetro
- C = capacità termica del calorimetro
- T1 = temperatura iniziale dell'acqua
- T2 = temperatura finale dell'acqua
La capacità termica del calorimetro tiene conto del fatto che anche le sue parti componenti (contenitore, termometro, agitatore, ecc.) assorbono calore. È necessario pertanto predeterminare la capacità termica del calorimetro, cioè determinare la quantità di calore necessaria per innalzare di 1°C la temperatura di tale sistema: essa si può ottenere facendo svolgere nell'apparecchio una reazione la cui tonalità termica sia nota, oppure facendo passare una quantità nota di corrente elettrica, che viene dissipata come calore all'interno dello strumento.
A tal riguardo, svolgiamo un esempio numerico allo scopo di chiarirci le idee.
Esercizio
Si vuole tarare un calorimetro allo scopo di determinare la sua capacità termica C. A tale scopo viene fatta svolgere nell'apparecchio una reazione di combustione che svolge complessivamente 9908 J e che innalza la temperatura del calorimetro da 20°C a 30°C.
Sapendo che all'interno del calorimetro sono presenti 200 g di acqua, si determini la sua capacità termica C.
Svolgimento dell'esercizio
L'esercizio propone il calcolo della capacità termica del calorimetro. Ricordiamo che la capacità termica (indicata con la lettera C) è una grandezza fisica definita dal rapporto tra la quantità di calore ΔQ assorbita da una certo materiale e il corrispondente aumento di temperatura ΔT; nel Sistema Internazionale si misura in J/K.
Per il calcolo della capacità termina del calorimetro applichiamo la relazione che ci permette il calcolo della quantità di calore messa in gioco nella reazione di combustione fatta avvenire all'interno del calorimetro stesso:
![]()
in cui, nel nostro caso:
- Q = 9908 J
- m = 200 g
- C = ?
- T1 = 20°C
- T2 = 30 °C
Sostituendo in modo opportuno, si ha che:
9908 = 200 · 4,184 (30-20) + C · (30-20)
Svolgendo i calcoli si ha che:
9908 = 8368 + C · 10
1540 = C · 10
C = 1540 : 10 = 154,0 J/°C
Pertanto la capacità termica del calorimetro corrisponde a 154,0 J/°C.
Calorimetro a ghiaccio
Il calorimetro a ghiaccio è basato sul fatto che il volume di una data massa di ghiaccio è maggiore del volume della stessa massa di acqua liquida. Se la reazione da studiare è esotermica, il calore svolto fa fondere una parte del ghiaccio attorno all'ambiente di reazione.
La diminuzione di volume crea una depressione nel serbatoio di mercurio, il quale viene aspirato nel becher. La diminuzione di peso di quest'ultimo permette di risalire al calore di reazione.
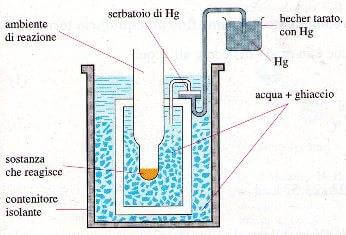
Calorimetro a ghiaccio
Questo tipo di calorimetro si presta a misurare le variazioni termiche delle reazioni che avvengono in soluzione.
Studia con noi