pH di acidi e basi forti molto diluiti
Come si calcola il pH di acidi e basi forti molto diluiti
Proviamo a determinare il pH di una soluzione di HCl avente una concentrazione 10-7 mol/l.
Applicando il ragionamento visto per il calcolo del pH di acidi forti, la soluzione dovrebbe avere pH = 7. Si arriva al risultato paradossale che una soluzione che contiene un acido ha un pH neutro!
In effetti nei casi in cui la concentrazione dell'acido CA scende sotto le 10-6 mol/l, non è più possibile trascurare, nel calcolo del pH, gli ioni H+ proveniente dalla dissociazione dell'acqua.
In questi casi vanno considerati entrambi gli equilibri:
![]()
L'acido forte è completamente dissociato e quindi la concentrazione degli ioni H+ provenienti da esso è pari a 10-7 mol/l.
La concentrazione degli ioni H+ provenienti dall'acqua però non è 10-7M in quanto l'acqua, in risposta all'aumentata concentrazione degli ioni H+ da parte dell'acido, sposta il suo equilibrio verso sinistra (principio di Le chatelier) contribuendo ad un apporto di ioni H+ minore di 10-7 mol/l.
Indicando con x la concentrazione degli ioni OH− provenienti dalla dissociazione dell'acqua, la concentrazione totale degli ioni H+ presenti in soluzione è data dalla somma tra la concentrazione degli ioni H+ provenienti dall'acido debole (10-7M) e la concentrazione degli ioni H+ provenienti dall'acqua (x). Pertanto:
[OH−] = x
[H+] = x + 10-7
Siccome tali concentrazioni devono soddisfare il prodotto ionico dell'acqua, possiamo scrivere:
![]()
Risolvendo in x l'equazione di secondo grado, si ottiene:
x = 6,18 · 10-8 M
Per cui:
[H+] = x + 10-7 = 6,18 · 10-8 + 10-7 = 1,62 · 10-7 mol/l
Da cui:
pH = 6,79
Calcolo pH di acidi e basi forti molto diluiti: metodo alternativo
Allo stesso risultato si poteva arrivare impostando il seguente sistema a due equazioni e due incognite ([H+] e [OH−]):
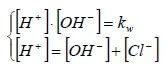
La prima equazione del sistema è l'equazione del prodotto ionico dell'acqua. La seconda equazione è il "bilancio di carica" che si ricava applicando il principio di elettroneutralità: la concentrazione totale delle cariche positive deve essere uguale alla concentrazione totale delle cariche negative.
Si osservi che [Cl−] non è un'incognita in quanto deriva dalla completa dissociazione dell'acido e nel nostro caso vale 10-7 mol/l.
Per un generico acido di concentrazione CA, vale quindi:
[Cl−] = CA
In tali casi, il sistema a due equazioni e due incognite diventa:
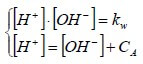
Ricavando [OH−] dalla prima equazione e sostituendolo nella seconda, si ha:
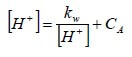
e, riordinando:
![]()
Risolvendo l'equazione di secondo grado rispetto all'incognita [H+], si ha:
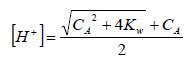
Dalla quale, nota la concentrazione CA dell'acido, è possibile determinare il pH di un acido forte molto diluito.
Determinazione del pH di una base forte molto diluita
Per una base forte molto diluita di concentrazione Cb (Cb <10-6M) , il sistema di equazioni è il seguente:
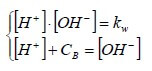
Esplicitando [OH−] dalla prima equazione e sostituendolo nella seconda, si ha:
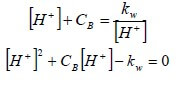
Risolvendo l'equazione di secondo grado rispetto all'incognita [H+], si ha:
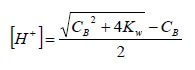
Dalla quale, nota la concentrazione Cb della base, è possibile determinare il pH di una base forte molto diluita.
Esercizi sul pH
Li trovi al seguente link: esercizi sul pH.
Quiz sul pH
Se ti interessano li trovi qui: quiz sui pH.
Studia con noi