Chinasi
Che cosa sono le chinasi?
Le Chinasi sono una famiglia di proteine deputate alla fosforilazione di altre molecole organiche.
La fosforilazione è il trasferimento di un gruppo fosfato da una molecola donatrice al substrato specifico. La molecola da cui le chinasi prelevano il gruppo fosfato è nella maggioranza dei casi l'ATP, più raramente un GTP.
I substrati fosforilati dalle chinasi sono molti; nella maggior parte dei casi però si tratta di proteine. In questo caso l'enzima è genericamente indicato come protein-chinasi, in modo da distinguerlo dalle (più rare) chinasi che fosforilano lipidi, carboidrati, singoli amminoacidi o nucleotidi.
La fosforilazione di una proteina rappresenta il sistema più utilizzato dalle cellule per regolare una via metabolica.
Attraverso l'aggiunta del gruppo fosfato le proteine possono essere attivate o disattivate. In alcuni casi l'attivazione o la disattivazione sono dirette, in altri casi sono mediate dal legame con un altra molecola, che può avvenire solo se la proteina target è fosforilata (regolazione positiva) o defosforilata (regolazione negativa).
La regolazione dell'azione delle proteine mediante fosforilazione rappresenta una via di controllo molto diffusa per numerose vie metaboliche di grande importanza.
Proteina chinasi: tipologie, strutture e funzionamento
La classe di chinasi che ha come bersaglio le proteine è la più ampia e diffusa. Questa classe di enzimi è in grado di attaccare selettivamente i residui di tirosina delle proteine bersaglio oppure uno tra i residui di Serina e Treonina. Questi due amminoacidi, infatti, hanno notevoli affinità e pertanto molte chinasi riescono ad agire indifferentemente su entrambi.
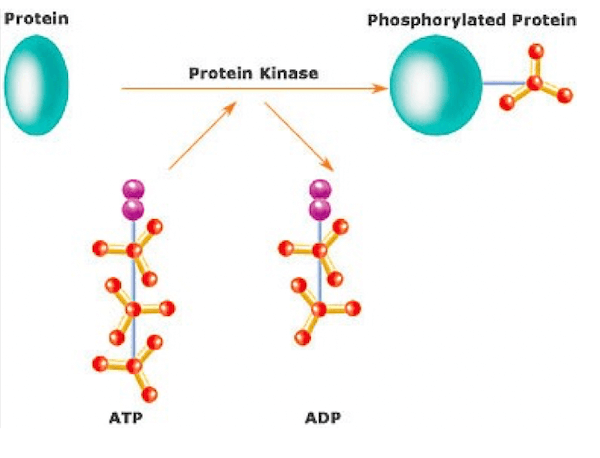
Il ruolo delle protein-chinasi è trasferire un gruppo fosfato da una molecola di ATP ad un residuo di tirosina, serina o treonina di una specifica proteina bersaglio.
Le tirosina chinasi sono coinvolte nella regolazione di processi fondamentali come crescita, differenziamento, metabolismo e apoptosi. In relazione al coinvolgimento nei meccanismi apoptotici, le tirosina chinasi possono partecipare allo sviluppo ed alla eventuale risoluzione di tumori nell'organismo, per cui sono oggetto di specifiche ricerche medico-scientifiche.
Esistono due tipi di tirosina chinasi: quelle recettoriali, che sono transmembrana, e quelle citoplasmatiche che non possiedono domini extracellulari.
Tirosina chinasi transmembrana (recettori tirosina-chinasi)
Le tirosina chinasi di tipo recettoriale sono caratterizzate da 5 regioni:
- La regione extracellulare, che rappresenta il sito di legame per il ligando, ossia la molecola che determina l'attivazione della proteina;
- Il dominio transmembrana, composto da una unica alfa-elica;
- Il dominio Regolatorio;
- Il sito catalitico intracellulare;
- Un dominio C-terminale aggiuntivo ove sono collocati dei residui dell'amminoacido tirosina.
Il dominio catalitico, dove avviene l'interazione tra l'enzima, il substrato da fosforilare e l'ATP, è composto da due lobi e dal sito di riconoscimento del nucleotide tri-fosfato.
Questo è posizionato nel centro tra i due lobi ed è a sua volta costituito da 5 sub-regioni. Tre di queste prendono contatto con l'ATP riconoscendo i suoi elementi specifici (la base azotata, lo zucchero e il gruppo fosfato) mentre gli altri due non prendono contatto con il nucleotide e hanno una funzione presumibilmente di tipo strutturale.
Quando il ligando interagisce con il recettore nell'ambiente extracellulare, questo subisce una dimerizzazione e diviene capace di reclutare e legare l'ATP. L'interazione con l'ATP rende attivi i siti di legame per le proteine bersaglio e consente il trasferimento dei gruppi fosfato.
Dopo l'interazione col ligando, le chinasi vengono trasportate all'interno della cellula in vescicole formate dall'invaginazione della membrana, che vanno a fondersi con i lisosomi per consentire la degradazione enzimatica dell'enzima e conseguentemente l'interruzione del processo.
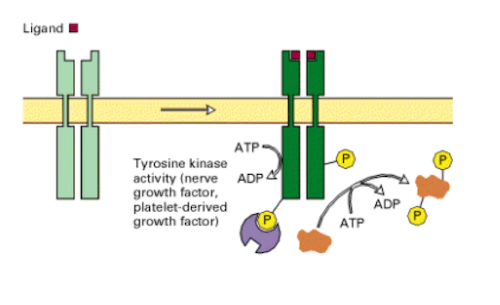
Un recettore tirosina-chinasi è attivato dal legame con il ligando nel dominio extracellulare della proteina, in seguito al quale opera la fosforilazione della proteina bersaglio nel citoplasma e dà avvio alla trasduzione del segnale.
Tirosina chinasi non recettoriali
Le tirosina chinasi citoplasmatiche sono anch'esse coinvolte nella regolazione di numerosi importanti processi fisiologici.
Non contengono, a differenza delle precedenti, domini transmembrana e possono essere del tutto disperse nel citosol oppure collegate alla parte interna della membrana mediante la porzione N-terminale.
Il ruolo principale svolto da queste proteine è quello di mediare la risposta dei linfociti T e B del sistema immunitario.
Dal punto di vista strutturale questi enzimi sono generalmente organizzati in maniera modulare e i vari moduli sono tenuti insieme da sequenze di collegamento.
Il sito catalitico è formato da due lobi asimmetrici, uno più piccolo dove avviene l'interazione con l'ATP e uno più grande che lega il substrato da fosforilare. Al centro tra i due si colloca una fessura dove ha luogo il trasferimento del gruppo fosfato da un substrato all'altro.
Serina-treonina chinasi
L'altra grande famiglia di protein-chinasi è quella costituita dalle chinasi specifiche per la Serina e la Treonina.
Questa classe di enzimi è coinvolta nella regolazione di molteplici processi, tra cui alcune fasi del ciclo cellulare.
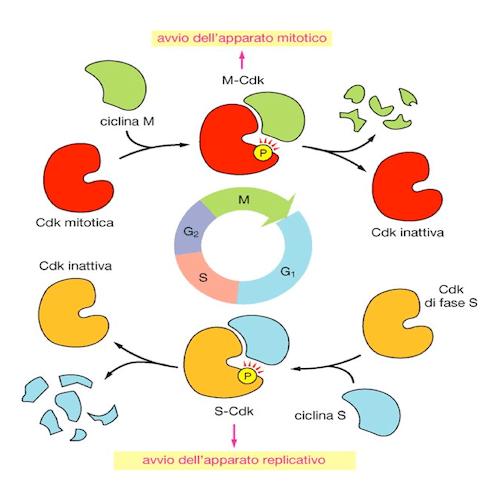
Le chinasi ciclina dipendenti, un gruppo particolarmente noto di serina-treonina chinasi (Cdk, in rosso nella figura) sono fondamentali per regolare l'entrata e l'uscita dalle varie fasi del ciclo cellulare.
In particolare le chinasi di questo tipo prendono il nome di "Aurora" e nei mammiferi ne esistono di 3 sottotipi: A, B e C, responsabili dell'assemblaggio del fuso mitotico, della duplicazione e della corretta separazione del centrosoma e dell'allineamento dei cromosomi sulla piastra metafasica.
Ciascuna delle tre tipologie di chinasi Aurora è composta da tre domini: un dominio catalitico, che mostra una sequenza molto ben conservata ove è presente il sito di legame dell'ATP e due domini regolatori posizionati in corrispondenza delle estremità N e C della proteina.
La regione regolatoria N terminale è quella maggiormente variabile e da essa dipendono le differenze maggiori tra le varie chinasi Aurora nonché la capacità di selezionare substrati differenti e di posizionarsi in regioni differenti della cellula.
In questo dominio dell'enzima è presente, nelle varianti A e B, una sequenza specifica indicata con il nome KEN che è responsabile dell'interazione della proteina con il complesso Promotore dell'Anafase.
All'interno della regione C vi è invece un dominio definito D-Box, che riconosce le sequenze del Complesso Promotore dell'Anafase e opera la distruzione delle strutture molecolari (D = destroy).
Link correlati:
Che cos'è l'ecogenetica?
Che cos'è l'embriologia?
Studia con noi